
某中学化学实验小组为了证明和比较SO2和氯水的漂白性,设计了如图所示装置: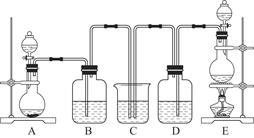
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的特质有________________。
(2)反应开始后,发现B、D两个集气瓶中的品红溶液都褪色,停止通气后,用热水浴给B、D两个集气瓶加热。两个集气瓶中的现象分别为:B____________________;D____________________。
(3)装置C的作用是______________________________________________________。
(4)该实验小组的甲、乙两位同学利用上述两个发生装置按图所示装置继续进行实验: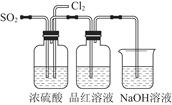
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题:
①指出在气体进入品红溶液之前,先将SO2和Cl2通过浓硫酸中的目的:________________________________________________________________________________________________________________________________________________。
②试分析甲同学实验过程中,品红溶液不褪色的原因是____________________________________________________________________________________________________________________________________________________________________________________________________________________。(结合离子方程式说明)
③你认为乙同学是怎样做到让品红溶液变得越来越浅的?
________________________________________________________________________。
科目:高中化学 来源: 题型:实验题
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成 CO2、SO2和H2O。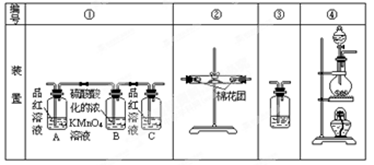
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是: 。(2分)
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号) → → → 。(2分)
(3)B瓶溶液的作用是 。(2分)本实验中能说明二氧化硫具有漂白性的实验现象是 。(2分)③中反应的离子方程式为 。(2分)
(4)装置②中所盛是无水硫酸铜,现象是 。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
制备氮化镁的装置示意图如下: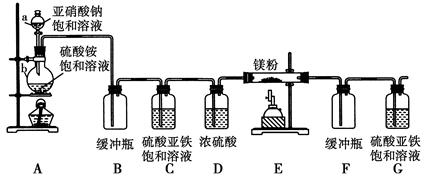
回答下列问题:
(1)检查装置气密性的方法是__________________________,
a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________。
(4)写出E中发生反应的化学方程式____________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象___________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是 (填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知AgNO3晶体加热分解生成两种单质和红棕色气体。用下列某些装置粗略测定混入了其他不分解也不参与反应的杂质的硝酸银的纯度,并进行有关实验(装置中必要的铁架台、铁夹、酒精灯等已略去),填写下列空白。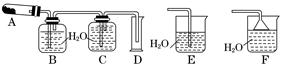
(1)写出AgNO3受热分解的化学方程式:_______________________________________________________________。
(2)测定AgNO3的纯度,可选用由A、B、C、D组成的装置,但其中不合理的是____________,该错误引起的后果是____________________________________________。
(3)B瓶中的空气对实验结果________(填“有”或“无”)影响,理由是____________________________________________________________________________。
(4)如果改进装置后,称取硝酸银试样4.00 g置于A中缓缓加热,待反应完全后,产生的气体通过B、C装置后,测得量筒中水的体积,并折算成标准状况下气体的体积为112 mL,则试样的纯度为________。
(5)如果加热Cu(NO3)2生成氧化铜,则加热分解所得气体应通入装置________(填“E”或“F”),其理由是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某研究性学习小组查阅资料得知,漂白粉与硫酸反应可以制得氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4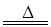 2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
2CaSO4+2Cl2↑+2H2O 。他们设计了如下制取氯气并验证其性质的实验。
试回答:(1)该实验中A部分的装置是____(填写装置的序号)。
(2)请你设计一个实验,证明洗气瓶C中的Na2SO3已经被氧化(简述实验步骤):____________________________。
(3)若D中反应后的溶液具有漂白性,请写出D装置中发生反应的离子方程式
__________________。
(4)该实验存在明显的缺陷,请你提出改进的方法___________。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol/L的Na2S2O3溶液作标准溶液滴定反应生成的碘,已知反应式为: 2Na2S2O3+I2=Na2S4O6 + 2NaI 反应完成时,共用去Na2S2O3
20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
【探究一】
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________________。
(2)另取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后收集到气体Y。
甲同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为______。
【探究二】
分析上述实验中SO2体积分数的结果,乙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略)。
(3)装置B中试剂的作用是_________________________________________。
(4)认为气体Y中还含有Q的理由是______________________________。(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于______(选填序号)。
a.A之前 b.A、B间 c.B、C间 d.C、D间
(6)如果气体Y中含有H2,预计实验现象应是____________________________。
(7)若要测定限定体积气体Y中H2的含量(标准状况下约有28 mL H2),除可用测量H2体积的方法外,可否选用质量称量的方法?做出判断并说明理由________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。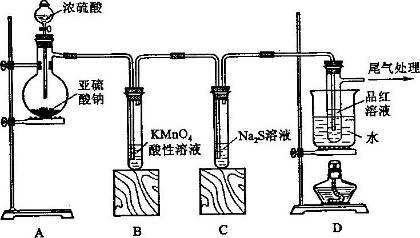
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是_________,其中发生反应的化学方程式_______________________;
(2)实验过程中,装置B、C中发生的现象分别是____________、___________,装置B中发生反应的离子方程式为_________________________________;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象________________________;
(4)尾气可采用___________________溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;② 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 。
(3)B中的现象是: ;
C的作用是: 。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 (写含m、b的表达式)。
⑸反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
A:只含有Fe3+;B:只含有Fe2+;C: 。
验证C的实验方法是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com