
 +2H2O.
+2H2O.分析 F被氧化生成乙二酸,则F是乙二醛,其结构简式为:OHCCHO,E被氧化生成乙二醛,则E是乙二醇,其结构简式为:CH2OHCH2OH,D和氢氧化钠水溶液发生取代反应生成乙二醇,C和溴发生加成反应生成D,则D是溴代烃;光照条件下,A和溴发生取代反应生成B,B是溴代烃,B在氢氧化钠的醇溶液中加热发生消去反应生成C,C和溴发生加成反应生成D,则D的结构简式为:CH2BrCH2Br,C的结构简式为:CH2=CH2,B的结构简式为:CH3CH2Br,A的结构简式为:CH3CH3,据此分析解答.
解答 解:(1)通过以上分析知,B的结构简式为:CH3CH2Br,C的结构简式为:CH2=CH2,B在氢氧化钠的醇溶液中加热发生消去反应生成C,则反应类型为消去反应,故答案为:CH2=CH2;消去反应;
(2)通过以上分析知,E是乙二醇,其结构简式为:CH2OHCH2OH,乙二醇和乙二酸能发生酯化反应生成环酯,方程式为:CH2OHCH2OH+HOOCCOOH$?_{△}^{浓H_{2}SO_{4}}$ +2H2O,
+2H2O,
故答案为:CH2OHCH2OH+HOOCCOOH$?_{△}^{浓H_{2}SO_{4}}$ +2H2O;
+2H2O;
(3)通过以上分析知,B的结构简式为:CH3CH2Br,C的结构简式为:CH2=CH2,则由B发生水解反应或C与H2O发生加成反应均生成化合物G为CH3CH2OH,
乙二酸是羧酸酸性较强,苯酚弱酸性,CH3CH2OH不能电离出氢离子,故羟基上活泼氢原子的活泼性为乙二酸>苯酚>水>G(乙醇),
故答案为:HOOCCOOH>C6H5OH>H2O>CH3CH2OH.
点评 本题考查了有机物的推断,以乙二酸为突破口采用逆推的方法进行推断,明确有机物的结构和性质是解本题关键,注意反应条件,反应条件不同导致产物不同,为易错点.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol 放出热量9.2KJ时,转移电子0.6 NA | |
| B. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| C. | 标准状况下,11.2L苯中含有碳氢键的数目为3NA | |
| D. | 0.1mol H2O2分子中含极性共价键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇完全燃烧生成CO2和H2O | |
| B. | 0.1 mol乙醇与足量钠反应生成0.05 mol氢气 | |
| C. | 乙醇能溶于水 | |
| D. | 乙醇能脱水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、D2O、HD均是化合物 | B. | 碱性氧化物均是金属氧化物 | ||
| C. | 能与NaOH溶液反应的盐均是酸式盐 | D. | CCl4、酒精、氯气均是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3:6 | B. | 6:3:2 | C. | 1:2:3 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
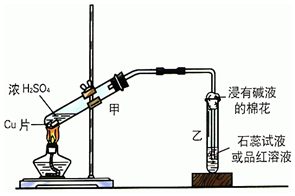 实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用如图装置来进行铜跟浓硫酸反应等一系列实验.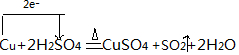
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com