
(18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= kJ?mol-1。
(2)利用氧化氮氧化物的流程如下:
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中  。
。
(常温下H2SO3的电离常数: )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH ___pH
___pH 。(填
。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
(l)—11601。(2)2NO2+4Na2SO3 N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
N2+4Na2SO4;1.12L。(3)向右;60。(4)①先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②<。③取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
解析试题分析:(l)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,根据盖斯定律:②×2—①,
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=—1160kJ?mol-1。(2)根据题给流程图知,反应Ⅱ为二氧化氮与亚硫酸钠溶液反应生成氮气和硫酸钠,化学方程式为2NO2+4Na2SO3 N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知,
N2+4Na2SO4;由反应I知,生成1molNO2转移5mol电子,若反应I中转移0.5mol电子,则反应Ⅰ 中生成0.1molNO2,由反应Ⅱ可知,生成N2的物质的量为0.05mol,标准状况下体积为1.12L。(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中溶液由强碱溶液转化为水解呈碱性的盐溶液,水的电离平衡向右移动;由H2SO3的二级电离常数表达式表达式知,  =Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
=Ka2/c(H+)=6.0×10—8/10—9=60。(4)①用Fe2(SO4)3晶体配制Fe2(SO4)3溶液时要注意防止铁离子水解,方法是先将Fe2(SO4)3晶体溶于一定浓度的硫酸,再加水稀释到所需的浓度。②由题给流程知,该过程中发生的总反应为:2SO2+O2+2H2O==2H2SO4,A、C两溶液的pH大小关系为:pHA<pHC。③验证溶液B是否仍具有处理废气的能力,即为检验溶液B中是否含有铁离子,实验的操作、现象和结论是取所得溶液少许,滴加硫氰酸钾溶液,若溶液变血红色,说明溶液B具有处理废气的能力,反之,不具有。
考点:考查焓变的计算、盖斯定律,氧化还原方程式的书写、电子守恒法和关系式法计算,水的电离、电离常数的计算及溶液的配制、离子检验。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:单选题
常温下pH=a的CH3COOH稀溶液与pH=b的NaOH稀溶液等体积混合,下列判断正确的是
| A.反应过程中,CH3COOH的电离程度增大 |
| B.若a+b=14,则混合后pH=7 |
| C.若混合后pH=5.3,则c(Na+)< c( CH3COO-) |
| D.若混合后CH3COOH与NaOH恰好完全反应,则混合前a+b<14 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在25ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是
A.在A、B间任一点(不含A、B点),溶液中可能有C(Na+) > C(CH3COO-) > C(OH-) > C(H+)
B.在B点,a>12.5,且有C(Na+) = C(CH3COO-) = C(OH-) = C(H+)
C.在C点,C(CH3COO-) > C(Na+) > C(OH-) > C(H+)
D.在D点,C(CH3COO-) + C(CH3COOH) = C(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)现有浓度为0.lmol/L的五种电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH
已知:
(1)上述五种溶液的pH由大到小的顺序为________。(填序号)
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是________。(填序号)
(3)在上述五种溶液中分别加入AlCl3溶液后,能产生无色气体的是_______:(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度_________(填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是__________________。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是___________________________。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
已知:N2(g)+O2(g)=2NO(g) △H=+180kJ/mol
2NO (g)+O2(g)=N2(g)+2CO2(g) △H=-112.3kJ/mol
则反应:2NO(g)+CO(g) N2(g)+2CO2(g)的△H是______。
N2(g)+2CO2(g)的△H是______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性 。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。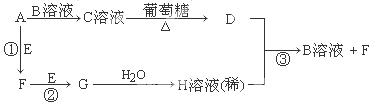
请回答下列问题:
(1)A分子是 分子(填“极性”或“非极性”),C溶液中的阳离子是 (写化学式,不考虑水的电离)。
(2)反应①的化学方程式为 ;反应③的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)常温下,某水溶液中存在的离子有:Na+、B2-、HB-、H+、OH-,存在的分子有H2O、H2B。根据题意回答下列问题:
(1)写出酸H2B的电离方程式 ﹑ 。
(2)常温下,已知0.1 mol·L-1二元酸H2B溶液中c(OH-) / c(H+)=1×10-6。
①常温下,0.1 mol·L-1H2B溶液的pH= ;
②写出该酸(H2B)与少量NaOH溶液反应的离子方程式: ;
(3)常温下,将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液充分混合(溶液体积变化忽略不计),所得溶液的pH= 。
(4)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= 。该温度下(t℃),0.1 mol·L-1HCl溶液的pH= ;
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某溶液中只存在OH-.H+.NH4+.Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是 (填序号)
(2)若溶液中只有一种溶质,则该溶质为 ,该溶液中离子浓度的大小关系为 (填序号)
(3)若关系③正确,则溶液中溶质为 。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”、“中性”)。
(5)25℃,pH="a" 的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va Vb(填>、<、=、无法确定)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列物质中,属于强电解质的是 (填序号,下同);属于弱电解质的是 ;属于非电解质的是 。
①氨气;②氨水;③盐酸;④醋酸(CH3COOH);⑤硫酸钡;⑥氯化银;⑦氯化钠溶液;⑧二氧化碳;⑨醋酸铵;⑩氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com