
| A. | 由Fe跟S直接化合可得FeS,类推出Cu跟S直接化合可得Cu2S | |
| B. | 金属镁失火不能用CO2灭火,金属钠失火也不能用CO2灭火 | |
| C. | NH4Cl、NH4I结构相似,将两种固体分别加热,分解都只生成卤化氢和氨气 | |
| D. | 原电池中通常是活泼金属做负极,不活泼金属做正极,用镁和铝与NaOH溶液构成原电池时,镁是负极 |
分析 A.S具有弱氧化性,变价金属和S反应生成低价硫化物;
B.镁在二氧化碳中燃烧生成C和MgO,钠燃烧生成过氧化钠和氧气,过氧化钠和二氧化碳反应生成碳酸钠和氧气;
C.卤化铵受热分解生成氨气和卤化氢,但HI受热易分解生成氢气和碘;
D.Mg、Al和氢氧化钠溶液构成的原电池中,Al易失电子作负极、Mg作正极.
解答 解:A.S具有弱氧化性,变价金属和S反应生成低价硫化物,Cu和Fe都是变价金属,所以Fe跟S直接化合可得FeS,Cu跟S直接化合可得Cu2S,故A正确;
B.镁在二氧化碳中燃烧生成C和MgO,钠燃烧生成过氧化钠和氧气,过氧化钠和二氧化碳反应生成碳酸钠和氧气,所以镁和钠着火都不能用二氧化碳灭火,故B正确;
C.卤化铵受热分解生成氨气和卤化氢,但HI受热易分解生成氢气和碘,所以碘化铵分解时不仅能生成氨气和碘化氢,还生成碘和氢气,故C错误;
D.Mg、Al和氢氧化钠溶液构成的原电池中,Al易失电子作负极、Mg作正极,故D错误;
故选CD.
点评 本题考查探究化学规律,为高频考点,明确物质性质是解本题关键,注意规律中的异常现象,易错选项是D,注意不能根据金属的金属性强弱判断原电池正负极,要根据失电子难易程度判断正负极,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BeCl2和PCl5 | B. | HClO和SO2 | C. | P4和COS(羰基硫) | D. | SiO2和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6molC+xmolD(x>0.6) | |
| B. | 1molA+0.5molB+1.5molC+xmolD(x>0.1) | |
| C. | 3molA+1.5molB+x molD(x≥0) | |
| D. | 1molA+0.5molB+3molC+xmolD(x>0) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
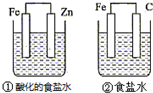
| A. | ①和②中铁的腐蚀均被加速 | |
| B. | ①和②中负极反应均是Fe-2e-═Fe2+ | |
| C. | ②中碳棒上反应是O2+2H2O+4e-═4OH- | |
| D. | ①装置中溶液pH会升高,②装置中溶液碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应开始到10s,用Z表示的反应速率为0.158 mol•L-1•s-1 | |
| B. | 反应开始到10s,X的物质的量浓度减少了0.79 mol•L-1 | |
| C. | 反应开始到10s,Y的物质的量的减少是0.79mol | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com