
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2CO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
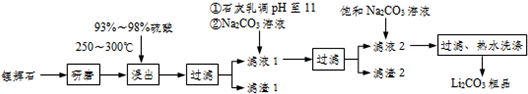
分析 锂辉石主要成分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素,研磨在加热条件下用浓硫酸酸浸后过滤得到Li2SO4,硫酸镁和硫酸钙,滤渣Ⅰ为Al2O3•4SiO2•H2O↓,滤液加入为石灰乳是氢氧化钙,提供氢氧根离子和钙离子,加入碳酸钠沉淀钙离子,更完全的沉淀镁离子和碳酸根离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
(1)依据过滤装置和操作步骤选择需要的玻璃仪器;
(2)滤渣I中分离制取Al2O3,加入过量酸溶解生成铝盐,加入过量一水合氨沉淀铝离子生成氢氧化铝沉淀,过滤得到滤渣3为氢氧化铝,灼烧得到氧化铝,步骤Ⅱ中反应是铝离子生成氢氧化铝的反应;
(3)滤渣Ⅰ为Al2O3•4SiO2•H2O,滤液加入为石灰乳是氢氧化钙,提供氢氧根离子和钙离子,加入碳酸钠沉淀钙离子,更完全的沉淀镁离子和碳酸根离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
(4)依据图表分析可知碳酸锂溶解度随温度升高减小;
(5)电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂.
解答 解:锂辉石主要成分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素,研磨在加热条件下用浓硫酸酸浸后过滤得到Li2SO4,硫酸镁和硫酸钙,滤渣Ⅰ为Al2O3•4SiO2•H2O↓,滤液加入为石灰乳是氢氧化钙,提供氢氧根离子和钙离子,加入碳酸钠沉淀钙离子,更完全的沉淀镁离子和碳酸根离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
(1)过滤操作是在过滤器中进行,滤液流入烧杯,分离的溶液需沿玻璃棒慢慢注入,需要的玻璃仪器为漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(2)滤渣I中分离制取Al2O3,加入过量酸溶解生成铝盐,加入过量一水合氨沉淀铝离子生成氢氧化铝沉淀,过滤得到滤渣3为氢氧化铝,灼烧得到氧化铝,步骤Ⅱ中反应是铝离子生成氢氧化铝的反应,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
故答案为:D;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)滤渣Ⅰ为Al2O3•4SiO2•H2O,滤液加入为石灰乳是氢氧化钙,向滤液Ⅰ中加入石灰水调pH为11的作用是提供氢氧根离子更完全的沉淀镁离子,加入碳酸钠沉淀钙离子,过滤得到滤液主要是Li2SO4,加入饱和碳酸钠沉淀锂离子为碳酸锂,滤渣2主要成分有Mg(OH)2和CaCO3;
故答案为:让Mg2+生成Mg(OH)2沉淀;让Ca2+生成 CaCO3沉淀;Mg(OH)2和CaCO3;
(4)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”,图表中碳酸锂溶解度随温度升高减小,减少沉淀的损失,
故答案为:Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失;
(5)电解后向LiOH溶液中加入过量NH4HCO3溶液,氢氧化锂与碳酸氢铵反应生成碳酸锂的方程式为2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O,
故答案为:2LiOH+NH4HCO3=Li2CO3↓+NH3•H2O+H2O.
点评 本题考查了物质生产流程的分析判断,流程分析,为高频考点,侧重于学生分析能力,有利于培养学生良好的科学素养,注意把握物质性质的应用,题目侧重铝及其化合物性质的应用,氧化铝的提取方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 离子晶体中只含有离子键 | |
| D. | 分子晶体中只存在分子间作用力,不含化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
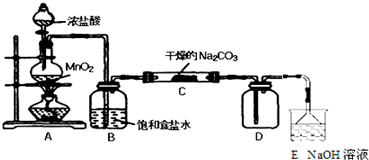
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
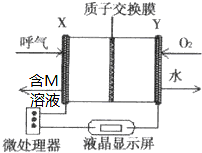 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| B. | 氢氧化镁分解时吸收大量热量,可添加到合成树脂中做阻燃剂 | |
| C. | 酒精能使蛋白质变性,无水酒精在医学上常被用于消毒 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com