
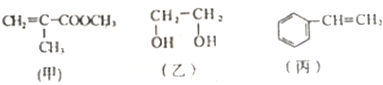
| A. | 甲物质可以在引发剂作用下生成有机高分子化合物 | |
| B. | 甲、乙、丙三种物质都可以发生加成反应 | |
| C. | 丙物质能够使酸性高锰酸钾溶液褪色 | |
| D. | 1mol乙物质可与2mol钠完全反应生成1mol氢气 |
分析 A.甲中含有碳碳双键,具有烯烃性质;
B.乙中不含不饱和键或苯环,不能发生加成反应;
C.丙中含有碳碳双键,具有烯烃性质;
D.醇羟基能和Na反应生成氢气,且醇羟基和钠以1:1反应.
解答 解:A.甲中含有碳碳双键,具有烯烃性质,所以能发生加聚反应生成高分子化合物,故A正确;
B.乙中不含不饱和键或苯环,所以没有烯烃和苯的性质,不能发生加成反应,故B错误;
C.丙中含有碳碳双键,具有烯烃性质,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故C正确;
D.醇羟基能和Na反应生成氢气,且醇羟基和钠以1:1反应,1mol乙物质可与2mol钠完全反应生成1mol氢气,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系即可解答,侧重考查烯烃、醇的性质,注意醇羟基和钠反应比例关系,易错选项是D.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
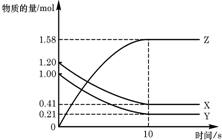 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
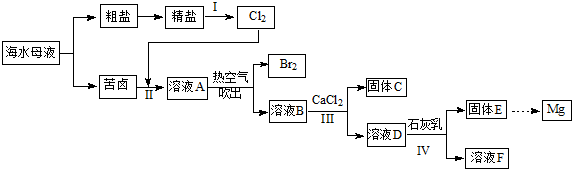
 (1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.
(1)K4[Fe(CN)6]中Fe2+与CN-两种离子之间的作用力是配位键,基态Fe2+的电子排布式1s22s22p63s23p63d6 或[Ar]3d6 ,1molCN-中含有π键的数目为2NA.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能与NaOH溶液反应,而乙醇不能 | |
| B. | 甲苯能够使酸性KMnO4溶液褪色,而苯不能 | |
| C. | 相等物质的量的甘油和乙醇分别与足量金属钠反应,甘油产生的H2多 | |
| D. | 在催化剂作用下苯能与液溴反应,而苯酚与溴水反应不需要催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
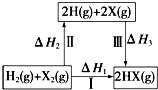
| A. | 2H(g)+2X(g)═2HX(g)△H3<0 | |
| B. | 生成HX的反应热与途径无关,所以△H1=△H2+△H3 | |
| C. | F、Cl、Br的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多 | |
| D. | F2、Cl2分别发生反应I,同一温度下的平衡常数分别为K1、K2,则K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
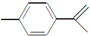 ,下列关于这种物质的说法中不正确的是( )
,下列关于这种物质的说法中不正确的是( )| A. | 该物质难溶于水 | |
| B. | 分子式为C10H14 | |
| C. | 既能发生取代反应,又能发生加成反应 | |
| D. | 既能使酸性高锰酸钾褪色又能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与水反应时.增加水的用量 | |
| B. | Al与稀硫酸反应制取H2时.改用浓硫酸 | |
| C. | Na2SO4与BaCl2两种溶液反应时.增大压强 | |
| D. | 大理石和盐酸反应制取C02时.将块状大理石改为粉末状 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com