
 的准确命名是( )
的准确命名是( )| A. | 3,3二甲基-4-乙基戊烷 | B. | 3,3,4-三甲基已烷 | ||
| C. | 3,3,4,-三甲基已烷 | D. | 2,3,3-三甲基已烷 |
分析 烷烃的命名方法是:
①选主链:找准一“长”一“多”,即碳链最长,支链最多,
从分子中找出最长碳链作为主链.若有几条等长碳链,则应当选择支链最多的作为主链;
②编C号:比较一“近”一“小”,即离支链最近,支链位号之和最小,
从离支链最近的一端开始对主链C原子进行编号.若主链两端离支链的距离一样,则应当选择支链位置号数总和较小的编号方向;
③写名称:基名同,要合并;逗号隔,短线分;先简后繁不要争,
取代基名称相同的要合并写,不同位置之间以“,”隔开,阿拉伯数字与汉字之间以“-”分开;取代基按先简后繁顺序书写.
解答 解: 最长的碳链为含有乙基的链,有6个碳原子,称己烷,从距离连接2个甲基的碳原子近的一段编号,取代基甲基分别在3、3、4号,若从乙基上的碳开始编号,取代基甲基分别在3、4、4号,根据支链位号之和最小,该有机物的名称为:3,3,4-三甲基己烷,
最长的碳链为含有乙基的链,有6个碳原子,称己烷,从距离连接2个甲基的碳原子近的一段编号,取代基甲基分别在3、3、4号,若从乙基上的碳开始编号,取代基甲基分别在3、4、4号,根据支链位号之和最小,该有机物的名称为:3,3,4-三甲基己烷,
故选:B.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性试题的考查,侧重对学生基础知识的检验和训练,该题的关键是明确有机物的命名原则.


科目:高中化学 来源: 题型:解答题
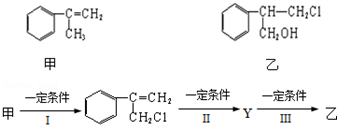
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
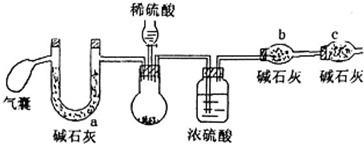
| 氢氧化钠浓度(mol•L-1) | 5 | 2 | 1 | 0.01 |
| 溶液变红后褪色的时间(s) | 8 | 94 | 450 | 长时间不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.| n(SO32-):,n(HSO3-) | 91:9 | 1:1 | 1:91 |
| PH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同一原子中,轨道的能量高低:1s>2s>3s>4s | |
| B. | 同一原子中,轨道的能量高低:3s<3p<3d | |
| C. | 不同能级中含有的原子轨道数:s-2;p-6;d-10 | |
| D. | M层上所具有的原子轨道数共有9个 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com