
| A. | 合金材料中可能含有非金属元素 | |
| B. | 燃烧化石燃料排放的废气中含大量CO2、SO2造成大气污染,使雨水pH=5.6,形成酸雨 | |
| C. | 废弃的玻璃、金属、纸制品是可回收利用的资源 | |
| D. | 用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用 |
分析 A.合金是金属与金属或者非金属熔合而成具有金属特性的材料;
B.酸雨pH<5.6;
C.根据可回收利用垃圾:废弃金属、废纸、废弃玻璃、废弃塑料、废弃电池;
D.可降解塑料分解产生CO2,CO2又合成聚碳酸酯可降解塑料.
解答 解:A.合金材料中可能含有非金属元素,例如生铁中含有碳,故A正确;
B.正常雨水的pH约为5.6,酸雨pH<5.6,故B错误;
C.废弃的玻璃、金属、纸制品是可回收利用的资源,故C正确;
D.可降解塑料分解产生CO2,CO2又合成聚碳酸酯可降解塑料,实现“碳”的循环利用,故D正确;
故选:B.
点评 本题考查较综合,涉及合金的成分、环境污染等,为高频考点,把握常见物质的性质、发生的化学反应及环境保护问题为解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
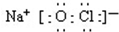 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
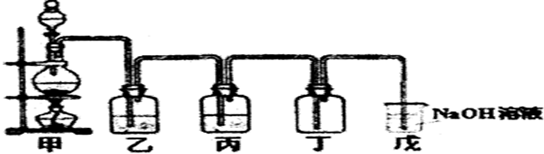
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
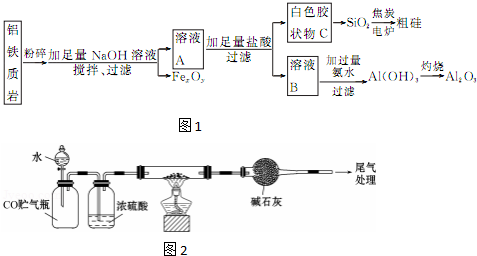
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA | |
| B. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| C. | 1mol Na2O2 固体中含离子总数为4NA | |
| D. | 标准状况下,2.24L辛烷所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(X2)=0.1mol•L-1 | B. | c(Y2)=0.3mol•L-1 | C. | c(X2)=0.2mol•L-1 | D. | c(Z)=0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
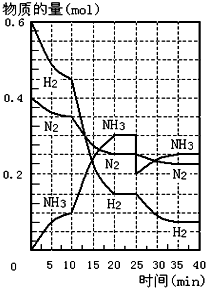 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com