
| A. | 常温下,某溶液水电离出的氢离子浓度是10-4 mol•L-1,则该溶液的PH可能是10 | |
| B. | 常温时,向硝酸钠溶液中滴加稀盐酸得到pH=4的混合溶液,则c(Na+)=c(NO3-) | |
| C. | 常温下,某溶液水电离出的氢离子浓度是10-10 mol•L-1,则该溶液的PH可能是10 | |
| D. | 常温下,PH值之和为14的醋酸和烧碱溶液,等体积混合后,溶液PH>7 |
分析 A.常温下,某溶液水电离出的氢离子浓度是10-4 mol•L-1,说明溶质促进了水的电离,应该为强酸弱碱盐和强碱弱酸盐;
B.钠离子和硝酸根离子不发生变化,根据物料守恒判断;
C.常温下,某溶液水电离出的氢离子浓度是10-10mol•L-1,溶质抑制了水的电离,可能为酸溶液或碱溶液;
D.醋酸为弱酸,混合液中醋酸过量,混合液呈酸性.
解答 解:A.常温下,某溶液水电离出的氢离子浓度是10-4 mol•L-1,水的电离程度最大了,说明溶质促进了水的电离,溶质为强碱弱酸盐或强酸弱碱盐,溶液的pH可能为4或10,故A正确;
B.常温时,向硝酸钠溶液中滴加稀盐酸得到pH=4的混合溶液,钠离子和硝酸根离子不水解,则c(Na+)=c(NO3-),故B正确;
C.常温下某溶液水电离出的氢离子浓度是10-10mol•L-1,水的电离程度减小,可能为酸溶液或碱溶液,溶液的pH可能为10或4,故C正确;
D.设醋酸的pH=a,ROH的pH=14-a,则醋酸和ROH溶液等体积混合时V×10-amol/L=V×1014-a-14mol/L,说明二者溶液中电离出的氢离子和氢氧根离子浓度相等,因醋酸为弱酸,不能完全电离,所以醋酸的浓度大于10-amol/L,醋酸有剩余,溶液显酸性,混合液的pH<7,故D错误;
故选D.
点评 本题考查了溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质的电离特点,试题培养了学生的灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

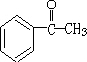 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2、H2O | B. | C2H4、CH4 | C. | Cl2、C2H2 | D. | N2H4、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
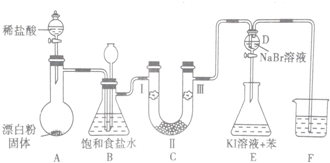
| 编号 | I | II | III |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 性质 元素 | A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )| A. | X2W能与WY2反应生成W | |
| B. | 气态氢化物的稳定性:W>Q | |
| C. | Y分别与其它四种元素均可形成至少两种以上化合物 | |
| D. | Y、Z、Q三种元素组成化合物的水溶液可能呈中性,也可能呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子既可以跟自身,又可以跟其他原子(如氢原子)形成4个共价键 | |
| B. | 碳原子性质活泼,可以跟多数元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成稳定的双键和三键 | |
| D. | 很多含碳的物质存在同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Na+、Ba2+、Cl-、SO42- | ||
| C. | Ca2+、HCO3-、C1-、K+ | D. | H+、Cl-、Na+、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com