
(14分)过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
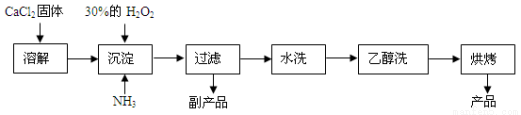
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是________;
(2)检验“水洗”是否合格的方法是________;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①____________;②____________。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知: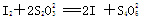 】
】
①CaO2的质量分数为____________(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”、“偏低”或“偏高”),原因是_________。
(14分)(1)CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl (2分)
(2)可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。(2分)
(3)①温度低可减少过氧化氢的分解,提高过氧化氢的利用率(2分);
②该反应是放热反应,温度低有利于提高CaO2·8H2O产率(2分)。
(4)①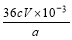 ,(2分)
,(2分)
②偏高(2分),在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3
增多,从而使测得的CaO2的质量分数偏高。(2分)
【解析】
试题分析:(1)向氯化钙溶液中加入过氧化氢、氨气可得到过氧化钙沉淀晶体,同时产物中有氯化铵,所以化学方程式是CaCl2+H2O2+2NH3+8H2O = CaO2·8H2O↓+2NH4Cl;
(2)过氧化钙晶体上可能含有氯离子,所以检验水洗是否干净则检验水洗后的溶液中是否含有氯离子即可。具体操作如下:可取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀。
(3)因为过氧化氢在加热时会分解,从而降低过氧化氢的使用率,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率;同时考虑过氧化钙的沉淀程度,该反应可能是放热反应,温度低对过氧化钙的沉淀有利;
(4)①根据得失电子守恒,过氧化钙与碘之间的关系式是CaO2~I2,而碘与Na2S2O3之间的关系式是2Na2S2O3~I2,所以CaO2~I2~2Na2S2O3,则过氧化钙的物质的量是Vc×10-3/2mol,所以过氧化钙的质量分数是Vc×10-3/2mol×72g/mol/ag×100%=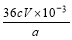
②若滴速太慢,则I-被空气中的氧气氧化为碘,则消耗Na2S2O3溶液体积增多,从而使测得的CaO2的质量分数偏高。
考点:考查制备实验方案的设计,物质质量分数的计算,化学方程式的书写


科目:高中化学 来源:2014-2015学年甘肃省高一上学期期中化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.纯净物一定由分子构成
B.混合物肯定由两种以上元素组成
C.同种分子构成的物质一定是纯净物
D.含有氧元素的化合物都是氧化物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
① 4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
② 2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是 。
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。
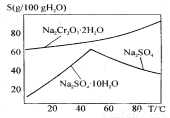
从Na2Cr2O7和 Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解 步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有 。
③则测定铁矿石中铁的含量的计算式为 (用字母表示,不用化简)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
下述实验设计能够达到目的的是
编号 | 实验目的 | 实验设计 |
A. | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
B. | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
C. | 检验溶液中是否含有Fe2+ | 向溶液中滴人氯水水后,再滴加KSCN 溶液 |
D. | 证明H2CO3酸性比H2SiO3强 | 将CO2通人Na2SiO3溶液中 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期期中考试化学试卷(解析版) 题型:选择题
2014年度诺贝尔化学奖授予了研制出超高分辨率荧光显微镜的三位科学家。该仪器可用于研究细胞结构和功能等。则下列有关仪器分析说法中错误的是
A.原子吸收光谱仪可用于测定物质中的金属元素
B.质谱仪不能用于分析有机化合物的结构
C.红外光谱仪可用于测定有机化合物的官能团
D.氢核磁共振仪能鉴别CH3COOCH2CH3与CH3CH2COOCH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
下列各反应对应的离子方程式正确的是
A.向100 mL 0.12 mol/L的Ba(OH)2溶液中通入0.02 mol CO2:OH-+CO2 = HCO3-
B.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2+ + 2OH-+2HCO3- = CaCO3↓+ CO32-+ 2H2O
C.向0.2 mol溴化亚铁溶液中通入0.2 mol氯气:2Fe2++4Br-+3Cl2 = 2Fe3++6Cl-+2Br2
D.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-= BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省焦作市高三上学期期中化学试卷(解析版) 题型:选择题
某可逆反应aA + bB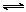 cC ;ΔH= -Q kJ/mol;在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
cC ;ΔH= -Q kJ/mol;在某温度下的平衡常数为K(K≠1),反应热为Q。保持温度不变,将方程式的书写作如下改变,则Q和K数值的相应变化为
A.写成2aA + 2bB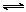 2cC,Q值、K值均扩大了一倍
2cC,Q值、K值均扩大了一倍
B.写成2aA + 2bB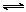 2cC,Q值扩大了一倍,K值保持不变
2cC,Q值扩大了一倍,K值保持不变
C.写成cC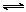 aA + bB,Q值、K值变为原来的相反数
aA + bB,Q值、K值变为原来的相反数
D.写成cC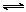 aA + bB,Q值变为原来的相反数,K值变为倒数
aA + bB,Q值变为原来的相反数,K值变为倒数
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三上学期期中理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.淀粉是天然高分子化合物
B.甲醛广泛应用于食品加工
C.溴乙烷和甲醇都能发生消去反应
D.聚丙烯能使溴水褪色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年云南省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
①漂白粉、水玻璃和铝热剂都是混合物;
②煤的干馏和石油的分馏都是化学变化;
③氨基酸、纯碱、芒硝和生石灰分别属于酸、碱、盐和氧化物;
④非极性键也可能存在于离子化合物中
A.①④ B.①③ C.②④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com