
分析 (1)用铝镁合金制造航母升降机,焊接前需先用NaOH溶液处理表面的氧化膜,是氧化铝溶解生成偏铝酸钠和水;
(2)氢氧化铝是弱碱,与胃酸的主要成份发生反应,使胃酸的酸度下降,同时对胃刺激性小;
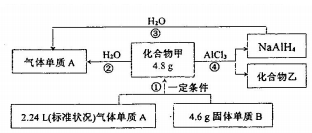
(3)由转化关系可知NaAlH4和水反应生成A,则A为H2,由反应④可知甲含有Na元素,乙含有Cl元素,可知甲为NaH,乙为NaCl,B为Na,以此解答该题.
解答 解:(1)用铝镁合金制造航母升降机,焊接前需先用NaOH溶液处理表面的氧化膜,是氧化铝溶解生成偏铝酸钠和水,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)氢氧化铝是弱碱,与胃酸的主要成份发生反应,反应的离子方程式为:Al(OH)3+3H+=Al3++3H2O,使胃酸的酸度下降,同时氢氧化铝难溶,电离出氢氧根离子浓度较小对胃刺激性小,Al(OH)3?Al3++3OH-,
故答案为:可与胃酸反应使胃液酸度降低,Al(OH)3+3H+=Al3++3H2O; 氢氧化铝碱性不强刺激性小,Al(OH)3?Al3++3OH-;
(3)由转化关系可知NaAlH4和水反应生成A,则A为H2,由反应④可知甲含有Na元素,乙含有Cl元素,可知甲为NaH,乙为NaCl,B为Na,
Ⅰ、甲为NaH,原子失电子能力由强到弱的顺序为Na>H;甲中所含化学键类型为离子键,故答案为:Na>H;离子键;
Ⅱ、上图中①②③涉及单质生成,属于氧化还原反应,属于非氧化还原反应的有④,故答案为:④;
Ⅲ、反应③为NaAlH4和水反应,化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑,故答案为:NaAlH4+2H2O=NaAlO2+4H2↑;
Ⅳ、甲在无水、一定条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3),脱锈过程发生反应的化学方程式为3NaH+Fe2O3$\frac{\underline{\;一定条件\;}}{\;}$2Fe+3NaOH,
故答案为:3NaH+Fe2O3$\frac{\underline{\;一定条件\;}}{\;}$2Fe+3NaOH;
Ⅴ、若反应②发生NaH+H2O=H2↑+NaOH,4.8NaH为0.2mol,由方程式可知,可制得气体A的物质的量为0.2mol,故答案为:0.2mol.
点评 本题主综合考查元素化合物知识,为高考常见题型,侧重考查学生的分析能力和计算能力,题目偏重考查常见元素以及其化合物的知识,综合性较强,难度较大.


科目:高中化学 来源: 题型:解答题
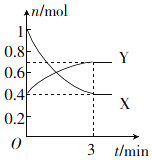 一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)?N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示.
一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)?N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在氧气中燃烧 | B. | 氢氧化钠溶液与盐酸的反应 | ||
| C. | 氢氧化钡晶体与氯化铵晶体的反应 | D. | 铝与氧化铁在高温条件下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
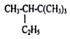 的系统命名为2,2,3,-三甲基戊烷;
的系统命名为2,2,3,-三甲基戊烷;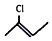 表示的分子式为C4H7Cl;
表示的分子式为C4H7Cl; .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制得Cl2 | B. | 电解熔融MgCl2制得金属Mg | ||
| C. | 高温下CO还原赤铁矿可用于炼铁 | D. | 电解熔融AlCl3制得金属Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量为36.5g | |
| B. | 含有6.02×1023个HCl分子 | |
| C. | 标准状况下的体积为44.8 L | |
| D. | 溶于1L水后,溶液中H+浓度为2mol.L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com