
下列过程放出热量的是(1)铝放入盐酸中(2)水蒸气变成掖态水(3)氧分子变成氧原子(4)煅烧石灰石生成生石灰和二氧化碳( )
|
| A. | (1)(2) | B. | (3)(4) | C. | (1)(3) | D. | (2)(4) |
考点:
吸热反应和放热反应.
分析:
根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱),C或氢气做还原剂时的反应;
液化要放热;形成化学键要放热.
解答:
解:(1)铝与盐酸反应是放热反应,故正确;
(2)水蒸气变成液态水是放热过程,故正确;
(3)断键吸收能量,氧分子变成氧原子是吸热反应,故错误;
(4)石灰石分解是吸热反应,故错误;
故选A.
点评:
本题考查放热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题,题目难度不大.


科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质(括号中为杂质),所选用的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂(足量) | 分离方法 | |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性KMnO4溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 乙酸(乙醛) | 新制Cu(OH)2 | 过滤 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ.电解法制高品质Al(OH)3装置如下(中间用离子交换膜隔开):
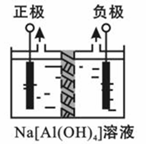
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e-时,将制得__________mol的Al(OH)3。
Ⅱ.制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为_________m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是____________________。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃的结构简式为: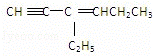 ,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
|
| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、6、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
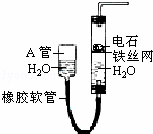
图中的实验装置可用于制取乙炔.请填空:
(1)图中,A管的作用是 .制取乙炔的化学方程式是 .
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应.
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中与物质化学性质无关的是( )
A. 用铂丝蘸取Na2CO3溶液在酒精灯焰上灼烧,观察到黄色火焰
B. 明矾可用作净水剂
C. 木条蘸取浓硫酸后变黑色
D. 用水(滴加了酚酞试液)和氨气做喷泉实验
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式次氯酸镁[BMH化学式为Mg2ClO(OH)3•H2O]难溶于水,相对稳定,是一种有开发价值的无机抗菌剂.某研发小组通过下列流程制备碱式次氯酸镁:
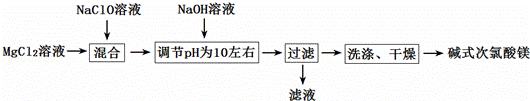
(1)在上述流程中,“过滤”操作用到的硅酸盐材质的仪器有
(2)NaClO的电子式为 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标.次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,则生成氯气的离子方程式为
(4)就抗菌和杀菌效果而言,氯制剂具有广谱、高效的特点,像BMH这样难溶又稳定的氯制剂几乎别无他物.在酸性溶液中BMH具有杀菌、漂白作用的原因是 (用离子方程式表示)
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,其化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com