
【题目】实验室模拟“间接电化学氧化法”处理氨氮废水。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调剂溶液中氯离子浓度,如图所示进行模拟实验。
(1)阳极反应式为___。
(2)去除NH4+的离子反应方程式为___。

【答案】2Cl-﹣2e-=Cl2↑ 2NH4++3Cl2=8H++N2↑+6Cl-
【解析】
(1)阳极发生氧化反应,氯离子的放电生成氯气;(2)氯气具有氧化性,而铵根离子中氮是﹣3价,被氧化成氮气,氯气得电子生成﹣1价的氯离子,由此书写离子反应的方程式。
(1)阳极发生氧化反应,氯离子的放电生成氯气,电极反应的方程式为:2Cl﹣﹣2e﹣=Cl2↑,故答案为:2Cl﹣﹣2e﹣=Cl2↑;
(2)氯气具有氧化性,而铵根离子中氮是﹣3价,被氧化成氮气,氯气得电子生成﹣1价的氯离子,离子反应的方程式为2NH4++3Cl2=8H++N2↑+6Cl﹣,故答案为:2NH4++3Cl2=8H++N2↑+6Cl﹣。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
Ⅰ. 已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25℃) | Ka= 1.77×10-4 | Ka=4.3×l0-10 | Ka1=5.0×l0-7Ka2=5.6×l0-11 |
(1)0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3 -)(填“>”、“<”或“=”)。
(2)常温下,pH相同的三种溶液A.HCOONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
(3)室温下,—定浓度的HCOONa溶液pH =9,用离子方程式表示溶液呈碱性的原因是___________。
Ⅱ. 室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示。

(4)d点所示的溶液中离子浓度由大到小的顺序依次为_______________。
(5)b点所示的溶液中c(NH3·H2O) - c(NH4+)=______(用溶液中的其它离子浓度表示)。
Ⅲ. 已知Ksp(BaCO3) =2.6×l0-9,Ksp( BaSO4)=1.1×10-10.
(6)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =___________(保留三位有效数字)。
=___________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是重要的有机合成中间体,H为高分子化合物,其合成路线如图所示:
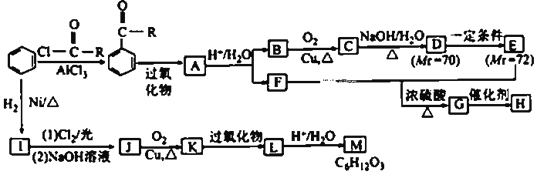
已知:①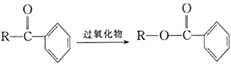 (R为烃基);
(R为烃基);
②2R-CH2CHO![]()
![]() 。
。
请回答下列问题:
(1)E中所含官能团的名称为____________。H的结构简式为____________。
(2)C→D涉及的反应类型有____________________________。
(3)A→B+F的化学方程式为___________________________________。
(4)D与银氨溶液反应的化学方程式为___________。
(5)符合下列条件的M的同分异构体有____________种(不考虑立体异构)。
①官能团种类和数目与M相同
②分子中含有1个-CH3和1个-CH2CH2-
③不含-CH2CH2CH2-
(6)请结合所学知识和上述信息,写出以苯甲醛和一氯乙烷为原料(无机试剂任选),制备苄基乙醛(![]() )的合成路线:________________________。
)的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g)![]() xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________;平衡常数K=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡________(填写字母序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的物质的量为n(B)=________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00mL0.100molL-1的氨水和醋酸铵溶液中分别滴加0.100molL-1的盐酸溶液,溶液pH随加入盐酸体积的变化如图所示。下列说法不正确的是( )
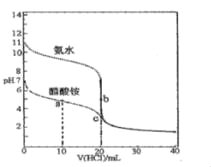
A.25℃时,Kb(NH3H2O)=Ka(CH3COOH)≈10-5
B.b点溶液中水的电离程度比c点溶液中的大
C.在c点的溶液中:c(Cl﹣)>c(CH3COOH)>c(NH4+)>c(OH﹣)
D.在a点的溶液中:c(NH4+)+2c(H+)═2c(CH3COO-)+c(NH3H2O)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为_______,该能层具有的原子轨道数为________、电子数为___________。
(2)硅主要以硅酸盐、___________等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以___________相结合,其晶胞中共有8个原子,其中在面心位置贡献__________个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为___________________________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
键能/(kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是______。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是___________________________。
(6)在硅酸盐中,SiO4- 4四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为______,Si与O的原子数之比为_________,化学式为__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42—,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、CrO42—B.CrO42—、Br-、Cl-C.Br-、Cl-、CrO42— D.Br-、CrO42—、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应或水解方程式不正确的是 ( )
①HCl+H2O![]() H3O++Cl-
H3O++Cl-
②AlCl3+3H2O=Al(OH)3+3HCl
③Na2CO3+2H2O![]() H2CO3+2NaOH
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3—+H2O=CO32—+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O![]() NH3·D2O+H+
NH3·D2O+H+
A.①②③④B.①②③C.②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com