
【题目】下列分子的VSEPR模型和分子的立体构型相同的是( )
A. NH3 B. CO2 C. H2O D. SO2
【答案】B
【解析】
价层电子对互斥模型(简称VSEPR模型),根据价电子对互斥理论,价层电子对数=σ键个数+孤电子对数,σ键个数=配原子个数,孤电子对数=![]() ×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型;
×(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数;分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;实际空间构型要去掉孤电子对,略去孤电子对就是该分子的空间构型;
价层电子对数为4,不含孤电子对,空间构型为正四面体结构;含有一对孤电子对,空间构型为三角锥形,含有两对孤电子对,空间构型是V型;
价层电子对数为3,不含孤电子对,空间构型平面三角形结构;含有一对孤电子对,空间构型为为V形结构;
价层电子对数是2且不含孤电子对,空间构型为直线形结构,据此判断。
A.氨气分子中氮价层电子对数=σ键个数+孤电子对数=3+![]() (5-3×1)=4,VSEPR模型为正四面体结构,含有一对孤电子对,所以其空间构型为三角锥形,VSEPR模型与分子立体结构模型不一致,选项A错误;
(5-3×1)=4,VSEPR模型为正四面体结构,含有一对孤电子对,所以其空间构型为三角锥形,VSEPR模型与分子立体结构模型不一致,选项A错误;
B.CO2分子中每个O原子和C原子形成两个共用电子对,价层电子对数=σ键个数+孤电子对数=2+![]() (4-2×2)=2,VSEPR模型为直线形结构,且不含孤电子对,所以为直线形结构,VSEPR模型与分子立体结构模型一致,选项B正确;
(4-2×2)=2,VSEPR模型为直线形结构,且不含孤电子对,所以为直线形结构,VSEPR模型与分子立体结构模型一致,选项B正确;
C.水分子中氧原子价层电子对数=2+![]() ×(6-2×1)=4,VSEPR模型为正四面体结构,含有2对孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,选项C错误;
×(6-2×1)=4,VSEPR模型为正四面体结构,含有2对孤电子对,略去孤电子对后,实际上其空间构型是V型,VSEPR模型与分子立体结构模型不一致,选项C错误;
D.二氧化硫分子中氧原子价层电子对数=2+![]() ×(6-2×2)=3,VSEPR模型为平面三角形结构,含有一对孤电子对,空间构型为为V形结构,VSEPR模型与分子立体结构模型不一致,选项D错误;
×(6-2×2)=3,VSEPR模型为平面三角形结构,含有一对孤电子对,空间构型为为V形结构,VSEPR模型与分子立体结构模型不一致,选项D错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式及有关应用的叙述中,正确的是
A. 甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+ 2O2(g) ═ CO2(g) + 2H2O(g) △H = -890.3kJmol-1
B. 已知强酸与强碱在稀溶液里反应的中和热为57.3kJmol-1,则![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)═
Ba(OH)2(aq)═![]() BaSO4(s)+H2O(l) △H < -57.3kJmol-1
BaSO4(s)+H2O(l) △H < -57.3kJmol-1
C. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g) + 3H2(g)![]() 2NH3(g) △H = -38.6kJmol-1
2NH3(g) △H = -38.6kJmol-1
D. 已知25℃、101KPa条件下:4Al(s) + 3O2(g) ═ 2A12O3(s) △H = -2834.9kJmol-1,4Al(s) + 2O3(g) ═ 2A12O3(s) △H = -3119.1kJmol-1,则O3比O2稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将O2、CH4、Na2O2置于密闭容器中,在250℃下用电火花引发化学反应。反应停止后使容器内恢复至250℃,容器内的气压为零。由此得出的结论正确的是( )
A. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaHCO3
B. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是Na2CO3和NaOH
C. 原O2、CH4、Na2O2物质的量之比为1∶2∶6,反应后容器内生成的固体是Na2CO3和NaOH
D. 原O2、CH4、Na2O2物质的量之比为2∶1∶4,反应后容器内生成的固体是NaHCO3和NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
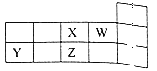
A.Y、Z、X三种元素的原子半径依次增大
B.X、Z的单质氧化性X<Z
C.Y的气态氢化物的热稳定性比Z的高
D.R元素与W同族且相邻周期,则R元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的NH4+:试液![]() 气体
气体![]() 试纸变蓝
试纸变蓝
C.检验试液中的I-:试液![]() 黄色溶液
黄色溶液![]() 深黄色溶液
深黄色溶液
D.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B. CCl4是非极性分子,分子中C原子处在4个Cl原子所组成的正方形的中心
C. H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央
D. CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化工厂对海水资源综合利用的示意图。根据以上信息,判断下列相关分析不正确的是
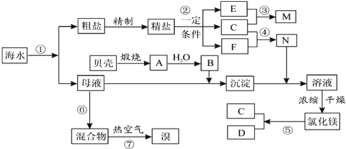
A.富集溴元素过程中,热空气吹出法利用了溴易挥发的性质
B.因氮气的化学性质相对稳定,冷却电解无水氯化镁所得的镁蒸气时,可选择氮气
C.反应⑥所用的气态氧化剂可从本厂生产烧碱处理循环利用或从本厂生产镁单质处理循环利用
D.MgCl2·6H2O必须在氯化氢氛围条件下加热制得无水氯化镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年1月,我国研发的“乙苯共氧化法制备环氧丙烷(![]() )成套技术”轰动了有机化工界,打破了国外对该项技术的封锁。下列说法错误的是( )
)成套技术”轰动了有机化工界,打破了国外对该项技术的封锁。下列说法错误的是( )
A. 环氧丙烷分子式力C3H6O
B. 环氧丙烷与环丙醇互为同分异构体
C. 环氧丙烷和乙苯均属于烃的衍生物,均可发生取代、氧化反应
D. 环氧丙烷分子中所有碳原子一定共面,其二氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.实验室用大理石与醋酸反应制取二氧化碳:CaCO3+2H+=Ca2++CO2↑+H2O
B.氯乙酸与足量的氢氧化钠溶液共热: CH2ClCOOH+OH- →CH2ClCOO-+H2O
C.苯酚钠溶液中通入少量二氧化碳: 2C6H5O-+CO2+H2O → 2C6H5OH+CO![]()
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- ![]() CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O
CH3COO-- + NH4+ +3NH3 + 2Ag↓+ H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com