
用一定体积的浓度为18mol•L﹣1浓硫酸配制100mL3.0mol•L﹣1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解④转移、洗涤 ⑤定容 ⑥摇匀
按要求回答下列问题:
(1)所需浓硫酸的体积是 取浓硫酸所用的量筒的规格是B.
从下列选项中选择:A.10mL B.25mL C.50mL D.100mL.
(2)对所配制的稀硫酸进行测定,发现其浓度大于3mol/L,配制过程中下列各项操作可能引起该误差的原因有
A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
B.定容时,俯视容量瓶刻度线进行定容
C.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作
D.转移溶液时,不慎有少量溶液洒到容量瓶外面
E. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(3)将正确配制的上述溶液取出10mL,将此10mL溶液稀释至1L,则硫酸电离出的H+物质的量浓度为
考点: 配制一定物质的量浓度的溶液.
专题: 实验题.
分析: (1)根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓硫酸的体积;
根据浓硫酸的体积选择量筒的规格,量筒的量程比浓硫酸体积稍大即可;
(2)分析操作对溶质物质的量、溶液体积的影响,根据c=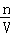 判断对所配溶液浓度的影响;
判断对所配溶液浓度的影响;
(3)依据c1V1=c2V2计算稀释后硫酸的浓度,再依据硫酸为二元强酸完全电离计算氢离子浓度即可.
解答: 解:(1)稀释前后物质的量不变,故有c1V1=c2V2,18mol•L﹣1×V1=100mL×3.0mol•L﹣1,解V1=16.7mL,需要选用量筒原则为:大而近,即选择25mL,故答案为:16.7;B;
(2)A.用量筒量取浓硫酸时,仰视刻度线取浓硫酸,导致量取浓溶液体积偏大,故浓度偏高;
B.定容时,俯视容量瓶刻度线进行定容,故导致稀溶液体积偏小,故浓度偏大;
C.将稀释后的稀硫酸立即转入容量瓶,未冷却,导致稀溶液体积偏小,故浓度偏大;
D.转移溶液时,不慎有少量溶液洒到容量瓶外面,导致浓溶液物质的量偏小,故浓度偏小;
E. 容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,配制过程中需要滴加蒸馏水,故此无影响;
F.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致稀溶液体积偏大,故浓度偏小,故选:ABC;
(3)将正确配制的上述溶液取出10mL,此溶液的浓度不变,即为3mol/L,将此10mL溶液稀释至1L,即有c1V1=c2V2,则稀释后硫酸的浓度c2=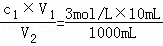 =0.03mol,硫酸为二元强酸,故硫酸电离出的H+物质的量浓度为0.03×2=0.06 moL/L,故答案为:0.06mol/L.
=0.03mol,硫酸为二元强酸,故硫酸电离出的H+物质的量浓度为0.03×2=0.06 moL/L,故答案为:0.06mol/L.
点评: 本题考查物质的量浓度有关计算,比较基础,侧重对基础知识的巩固,注意对公式的理解与灵活运用.


科目:高中化学 来源: 题型:
下列物质的分类正确的是()
碱 酸 盐 碱性氧化物 酸性氧化物
A Na2CO3 H2SO4 NaOH SO2 CO2
B NaOH HCl NH4Cl Na2O CO
C NH3•H2O CH3COOH NaCl Na2O2 SO2
D KOH HNO3 CaCO3 CaO SO2
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
关于晶体的自范性,下列叙述正确的是( )
|
| A. | 破损的晶体能够在固态时自动变成规则的多面体 |
|
| B. | 缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体晶块 |
|
| C. | 圆形容器中结出的冰是圆形的体现了晶体的自范性 |
|
| D. | 由玻璃制成规则的玻璃球体现了晶体的自范性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3:2:1时,三种溶液中Cl﹣的物质的量之比为()
A. 1:1:1 B. 1:2:3 C. 3:2:1 D. 3:4:3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于碱金属的电子结构和性质的叙述中不正确的是()
A. 碱金属原子最外层都只有一个电子,在化学反应中容易失去
B. 都是强还原剂
C. 都能在O2中燃烧生成过氧化物
D. 都能与水反应生成碱
查看答案和解析>>
科目:高中化学 来源: 题型:
能用H++OH﹣=H2O来表示的化学反应是()
A. Ba(OH)2溶液滴入稀硝酸中
B. NaHSO4溶液和澄清石灰水反应
C. 氢氧化镁和稀盐酸反应
D. 二氧化碳通入NaOH溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个小烧杯里,加入约20g已研磨成粉末的氢氧化钡晶体,将小烧杯放在事先已滴有3﹣4滴水的玻璃片上,然后再加入约10g NH4Cl晶体,并立即用玻璃棒迅速搅拌.试完成下列问题: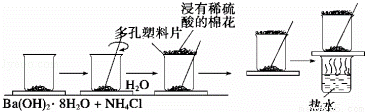
(1)写出有关反应方程式 ,该反应属于 反应.(填基本反应类型)
(2)实验中要立即用玻璃棒迅速搅拌的原因是 .
(3)如果实验中没有看到“结冰”现象,可能的原因是(列举三条)①
(4)“结冰”现象说明了该反应是吸 热(填“放”或“吸”),反应物的总能量比生成物的总能量
低(填“高”或“低”);
(5)在上述实验过程中,用浸有稀硫酸的湿棉花置于多孔塑料板上的作用是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com