
| A. | ①④⑤⑥⑦ | B. | ①⑤⑥⑦⑧ | C. | ②③④⑧ | D. | ①④⑤⑥⑦⑧ |
分析 常见影响反应速率的因素有浓度、温度、压强、催化剂以及固体表面积等,影响硫酸和锌反应的速率的因素有浓度、温度和固体的表面积大小,加快反应速率,应使浓度增大、温度升高或增大固体表面积,不影响生成氢气的总量,则硫酸的物质的量应不变,以此解答.
解答 解:①升高温度,活化分子百分数增加,反应速率增大,且氢气的总量不变,故正确;
②加入少量醋酸钠晶体,氢离子浓度减小,反应速率减慢,故错误;
③加入食盐水,氢离子的浓度减小反应速率减小,故错误;
④加入少量浓硫酸,生成二氧化硫气体,而不是生成氢气,故错误;
⑤加入少量硫酸铜溶液,锌置换出铜,可形成原电池反应,反应速率增大,且氢气的总量不变,故正确;
⑥加入少量石墨,构成原电池加快化学反应速率,但产生氢气的量不变,故正确;
⑦加入少量铜粉,构成原电池加快化学反应速率,但产生氢气的量不变,故正确;
⑧加入少量镁粉,镁比锌活泼,但氢离子的物质的量不变,所以反应速率加快,但产生氢气的量不变,故正确;
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气的物质的量之比为1:1,混合发生取代反应只生成CH3C1 | |
| B. | 甲烷与氯气的取代反应,生成的产物中CH3C1最多 | |
| C. | 甲烷与氯气的取代反应生成的产物为混合物 | |
| D. | 1mo1甲烷生成CCl4最多消耗2mo1氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化钙 | B. | 碳酸钠 | C. | 氢氧化钾 | D. | 次氯酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的草酸溶液含有H+数目为0.001NA | |
| B. | 当1molKMnO4被还原时强酸提供H+数目为NA | |
| C. | 1molHOOC-COOH含共用电子对数目为9NA | |
| D. | 该反应释放CO2分子数目为$\frac{V}{22.4}$NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:推断题
A~J是中学化学中常见的化学物质,它们之间的相互转化关系如下列框图所示(部分反应的产物未列出)。
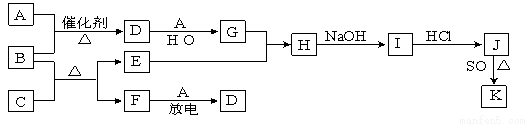
已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为 ;F的电子式为 。
(2)B和C反应的化学方程式为 。该反应中生成1molF时,转移的电子数为 mol
(3)E与G的稀溶液反应的离子方程式为: 。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:选择题
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
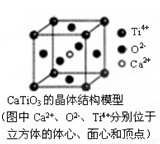
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高一上第一次月考化学试卷(解析版) 题型:选择题
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1(b-2a)mol·L-1 B.10(b-2a)mol·L-1
C.10(b-a)mol·L-1 D.10(2a-b)mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
(1)化学平衡常数K表示可逆反应进行程度,K值越大,表示  ,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
(2)在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g) CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。

(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
t1℃时物质浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①表中3~4min反应处于 状态;c1数值 0.08mol/L(填“>”“<”“=”)
②反应在4~5min,平衡向逆方向移动,可能的原因是 (单选),表中5~6min数值发生变化,可能的原因是 (单选)
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com