
 2NO2��g����H=" +57" kJ��mol��1����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�
2NO2��g����H=" +57" kJ��mol��1����һ��ʱ��Ը������ڵ����ʽ��з������õ��������ݣ�| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C��g�� ��2���ӷ�Ӧ�ﵽƽ�⣬��ʱ����0.2mol C��
2C��g�� ��2���ӷ�Ӧ�ﵽƽ�⣬��ʱ����0.2mol C��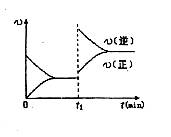
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
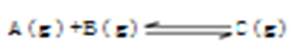 �ﵽƽ���������A��Ũ�Ȼ�����ѹǿʹƽ�������ƶ�������˵������ȷ����
�ﵽƽ���������A��Ũ�Ȼ�����ѹǿʹƽ�������ƶ�������˵������ȷ����| A��C�İٷֺ���һ������ |
| B��C��Ũ��һ������ |
| C��A�İٷֺ���һ������ |
| D��A��ת����һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��KI��Һ�д�������ƽ�⣺
��KI��Һ�д�������ƽ�⣺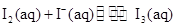 ��ij
��ij
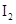 ��KI�����Һ�У�
��KI�����Һ�У�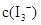 ���¶�T�Ĺ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬������˵������ȷ����
���¶�T�Ĺ�ϵ����ͼ��ʾ���������κ�һ�㶼��ʾƽ��״̬������˵������ȷ����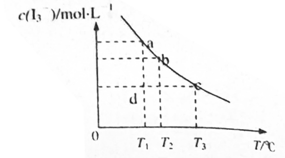
A����Ӧ |
B��״̬a��״̬b��ȣ�״̬bʱ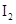 ��ת���ʸ��� ��ת���ʸ��� |
C����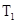 ʱ����Ӧ���е�״̬dʱ��һ���� ʱ����Ӧ���е�״̬dʱ��һ����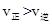 |
D���¶�Ϊ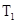 ʱ�����ƽ����ϵ�м���KI���壬ƽ�������ƶ� ʱ�����ƽ����ϵ�м���KI���壬ƽ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pZ (g)����H<0���ﻯѧƽ��ı����������б�������ȷ����
pZ (g)����H<0���ﻯѧƽ��ı����������б�������ȷ����| A������ѹǿ����ѧƽ�ⲻһ�������ƶ� |
| B��ͨ�뺤������ѧƽ�ⲻһ�������ƶ� |
| C������X��Y�����ʵ�������ѧƽ��һ�������ƶ� |
| D�������������䣬�����¶ȣ���ѧƽ��һ�������ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������H=��QkJ��mo��Q>0����
2NH3��g������H=��QkJ��mo��Q>0����| A��2Q2<Ql<Q | B��2Q2=Q1<Q | C��2Q2=Q1=Q | D��Ql<Q2<Q |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

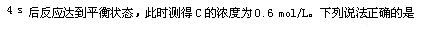
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)+H2O(g) ��H = ��49.0kJ��mo1��
CH3OH(g)+H2O(g) ��H = ��49.0kJ��mo1��
 mL��pH=11��NaOH��Һ
mL��pH=11��NaOH��Һ mL��Ϸ�Ӧ���ã�������˵������ȷ���� __��
mL��Ϸ�Ӧ���ã�������˵������ȷ���� __���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com