
| A. | l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA | |
| B. | 将lmol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA | |
| C. | 分子数目为0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ |
分析 A.Fe(NO3)3与足量HI反应时,Fe3+被还原为Fe2+,NO3-全部被还原为NO,据此分析;
B.氯气和水反应是可逆反应,氯元素存在为Cl2、HClO、Cl-、ClO-粒子;
C.氮气和氨气分子中都含有3个共用电子对,0.10.1NA个混合气体中含有0.3NA个共用电子对;
D.过氧化钠和二氧化碳反应方程式为2Na2O2+2CO2=2Na2CO3+O2,该反应Na2O2中O元素化合价由-1价变为0价和-2价,2mol过氧化钠反应增重56g,电子转移2mol,据此计算;
解答 解:A.Fe(NO3)3与足量HI反应时,Fe3+被还原为Fe2+,NO3-全部被还原为NO,故1molFe(NO3)3与足量HI反应时,转移10mol电子,故A错误;.
B.氯气和水反应是可逆反应,氯元素存在为Cl2、HClO、Cl-、ClO-粒子,将lmol Cl2通入水中,HClO、Cl-、ClO-粒子数之和小于2NA,故B错误;
C.氮气和氨气分子中都含有3个共价键,则分子数0.1NA的N2和NH3混合气体,原子间含有的共用电子对数目为0.3NA,故C正确;
D.过氧化钠和二氧化碳反应方程式为2Na2O2+2CO2=2Na2CO3+O2,该反应Na2O2中O元素化合价由-1价变为0价和-2价,2mol过氧化钠反应增重56g,电子转移2mol,将CO2通过Na2O2使其增重a克时,反应中转移电子数为$\frac{2a}{56}$×NA=$\frac{a{N}_{A}}{28}$,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的分析,主要是氧化还原反应电子转移计算、可逆反应中物料守恒、化学方程式定量计算等,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
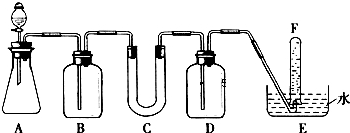
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | 石棉绒与过氧化钠 | 与CO2反应,产生O2 |
| D | 吸收未反应的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝化甘油在体内能够分解出NO,少量的NO会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛 | |
| B. | 侯氏制碱法的工艺流程应用了物质溶解度的差异 | |
| C. | 刚玉、红宝石、蓝宝石的主要成分是氧化铝,而青花瓷、石英玻璃、分子筛的主要成分是硅酸盐 | |
| D. | 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H+的作用下,溶液中黄色的CrO42-能被氧化为橙红色的Cr2O72- | |
| B. | 7.8 gNa2O2完全反应一定转移了0.1mol电子 | |
| C. | 只用溴水可鉴别出苯、四氯化碳、乙醇、乙醛、环己烯五种无色液体 | |
| D. | 常温下,NH4Cl和NH3•H2O混合的溶液pH一定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
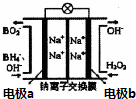 以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )
以NaBH4和H2O2为燃料的燃料电池可用于通信卫星.其负极材料采用Pt/C,正极材料采用MnO2,电池的工作原理如图所示.下列说法错误的是( )| A. | 电池放电时,Na+从a极区移向b极区 | |
| B. | 电极b采用MnO2,该极附近溶液的pH保持不变 | |
| C. | 该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O | |
| D. | 电池放电时,电子从a极经导线流向b极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)
(标明配位键);其中Al的杂化方式是sp3.(相对原子质量:Al-27;Cl-35.5)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体B2C3不能从溶液中制得 | |
| B. | C的氧化物对应水化物为强酸 | |
| C. | B的简单离子半径大于D的简单离子半径 | |
| D. | AD2分子中各原子最外层都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3俗名纯碱,其水溶液显弱碱性 | |
| B. | 该溶液中K+、Al3+、SO42-可以大量共存 | |
| C. | 加水稀释该溶液,溶液中$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| D. | 向该溶液中加入足量的氢氧化钙溶液的离子方程式为:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的溶液中:K+、Mg2+、I-、S2- | |
| B. | Br-不能大量存在的溶液中:Fe2+、Ca2+、Cl-、NO3- | |
| C. | c(H+)=10-12mol•L-1的溶液中:Na+、Ba2+、NO3-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com