
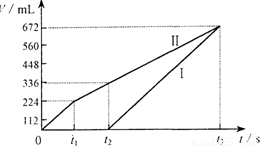
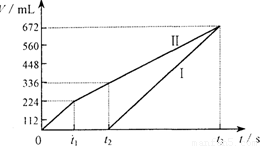
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
(1)0.1mol/L 0.1mol/L
(2)1 (3)0.72g
解析:电解NaCl与CuSO4混合溶液,阳极首先是氯离子放电生成氯气,然后是OH-放电生成氧气。阴极首先是铜离子放电析出铜,然后是氢离子放电生成氢气。电极反应式分别为4Cl--4e-=2Cl2↑、4OH--4e-=2H2O+O2↑,2Cu2++4e-=2Cu、4H++4e-=2H2↑。所以I是氢气,Ⅱ是氯气和氧气。由图像可知反应进行到t2时氯气的体积为224ml、氧气为112ml,其物质的量分别为0.01mol和0.005mol,转移电子0.01mol×2+0.005mol×4=0.04mol,根据得失电子守恒可知析出的铜为0.02mol,所以原混合溶液NaCl和CuSO4的物质的量浓度分别为![]() 、
、![]() 。在t1~t2阶段电解硫酸铜和水,生成氧气0.005mol,所以产生的氢离子为0.005mol×4=0.02mol,其浓度为0.1mol/L,故pH为1。在t2~t3阶段只电解水,生成氧气的体积为672ml-336ml=336ml,其物质的量为0.015mol,则消耗水是0.015mol×2=0.03mol,质量是0.03mol×18g/mol=0.54g。又因为在t1~t2阶段电解硫酸铜和水,其中氧气是0.005mol,消耗水0.005mol×2=0.01mol,质量是0.18g,所以共消耗水的质量是0.54g+0.18g=0.72g。
。在t1~t2阶段电解硫酸铜和水,生成氧气0.005mol,所以产生的氢离子为0.005mol×4=0.02mol,其浓度为0.1mol/L,故pH为1。在t2~t3阶段只电解水,生成氧气的体积为672ml-336ml=336ml,其物质的量为0.015mol,则消耗水是0.015mol×2=0.03mol,质量是0.03mol×18g/mol=0.54g。又因为在t1~t2阶段电解硫酸铜和水,其中氧气是0.005mol,消耗水0.005mol×2=0.01mol,质量是0.18g,所以共消耗水的质量是0.54g+0.18g=0.72g。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省东阳中学高二下学期第一次阶段性测试化学试卷(带解析) 题型:填空题
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
查看答案和解析>>
科目:高中化学 来源:2010年江西省高二上学期期中考试化学试卷 题型:计算题
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
查看答案和解析>>
科目:高中化学 来源:09-10学年江苏宿迁中学高二下学期期中考试化学卷 题型:计算题
常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如右图Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:
(1)原混合溶液NaCl和CuSO4的物质的量浓度。
(2)t2时所得溶液的pH。
(3)电解至t3时,消耗水的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com