
分析 (1)铜和稀硝酸反应生成硝酸铜和一氧化氮、水;
(2)n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,根据c=$\frac{n}{V}$进行计算;
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2×22.4L
0.3mol xL
,由此解答.
解答 解:(1)铜和稀硝酸反应生成硝酸铜和一氧化氮、水,反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,根据c=$\frac{n}{V}$=$\frac{0.3mol}{0.5L}$=0.6mol/L,故答案为:0.6mol/L;
(3)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 2×22.4L
0.3mol xL
x=4.48
故答案为:4.48L.
点评 本题考查化学方程式的计算,学生只要列出比例关系就可以迅速解题,同时也考查了学生认真审题的能力,比较容易.


科目:高中化学 来源: 题型:解答题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | e | f | h | |||||
| 3 | a | c | d | g | i | j | r | |
| 4 | b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
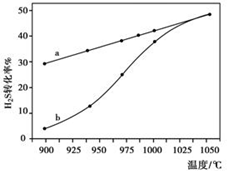 n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).
n内反应速率v(H2)=$\frac{0.4c}{t}$mol/(L•min)(用含c、t的代数式表示).| 流程1:气化炉中产生H2 | 流程2:燃烧炉中CaO再生 |
| 通入水蒸气,主要化学反应: I:C(s)+H2O(g)?CO(g)+H2(g) K1 II:CO(g)+H2O(g)?CO2(g)+H2(g) K2 III:CaO(s)+CO2(g)?CaCO3(s) K3 | 通入纯氧,主要化学反应: IV:C(s)+O2(g)=CO2(g)△H=-393.8kJ•mol-1 V:CaCO3(s)=CaO(s)+CO2(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中加入铁粉:Fe3++Fe=2Fe2+ | |
| B. | 将NH3通入H2SO4溶液中:NH3+H+=NH4+ | |
| C. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| D. | H2SO4溶液与Ba(OH)2溶液混合:H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
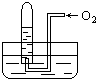 如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )
如图所示,试管中盛装的是红棕色气体,当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管;当向试管内鼓入氧气后,可以观察到试管中水面继续上升,经过多次重复后,试管被水充满,则原来试管中盛装的气体是( )| A. | 肯定是NO2气体 | B. | 肯定是O2与NO2的混合气体 | ||
| C. | 肯定是NO与O2的混合气体 | D. | 可能是NO与NO2的混合气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁、铜均为日常生活中常见的金属,有着广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: | |
| B. | 氢氧根离子的电子式: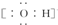 | |
| C. | 氯原子的结构示意图: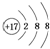 | |
| D. | 中子数为146、质子数为92的铀(U)原子:${\;}_{92}^{146}$U |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小为W>X>Z>Y | |
| B. | X、Y、Z的氢化物的水溶液均呈酸性 | |
| C. | W与Y形成的三原子化合物既含极性共价键又含非极性共价键 | |
| D. | Z元素的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com