
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)=0时,c(H+)=1×10-2 mol/L( )
B.V(NaOH)<10 mL时,不可能存在c(Na+)=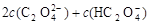
C.V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L
D.V(NaOH)>10 mL时, c(Na+)> c(C2O42-)> c(HC2O4-)
D
【解析】
试题分析:草酸氢钠溶液显酸性,说明草酸氢钠的电离程度大于其水解程度。因为草酸是弱电解质,所以0.01 mol•L-1 NaHC2O4溶液中,氢离子的浓度小于0.01mol/L,A不正确。加入氢氧化钠发生的反应为NaOH+NaHC2O4=Na2C2O4+H2O,二者恰好反应时,消耗氢氧化钠10ml。生成物草酸钠水解,溶液显碱性,C不正确。如果氢氧化钠的体积小于10ml,则二者反应后,溶液就有可能显中性。根据电荷守恒c(H+)+c(Na+)=2c(C2O42-)+c(HC2O4-)+c(OH-)可知,如果溶液显中性,则c(Na+)=2c(C2O42-)+c(HC2O4-),因此B也是不正确的。当氢氧化钠大于10ml时,溶液中含有氢氧化钠和草酸钠两种溶质,由于草酸钠的水解以第一步水解为主,且氢氧化钠的存在会抑制其水解,因此选项D是正确的。答案选D。
考点:溶液中离子浓度大小的比较
点评:溶液中离子浓度大小的比较依靠三大守恒定律和溶液的酸碱性。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年天津卷)草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是()
A.V(NaOH)== 0时,c(W)== 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)== 2 c(C2O![]() )+ c(HC2O
)+ c(HC2O![]() )
)
C.V(NaOH)== 10 mL时,c(W)== 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O![]() )>c(HC2O
)>c(HC2O![]() )
)
查看答案和解析>>
科目:高中化学 来源:2012-2013吉林省吉林一中高二下学期期中考试化学试卷(带解析) 题型:单选题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)="=" 0时,c(H+,W)="=" 1 × 10-2 mol/L |
B.V(NaOH)< 10 mL时,不可能存在c(Na+)="=" 2 c(C2O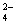 )+ c(HC2O )+ c(HC2O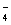 ) ) |
| C.V(NaOH)="=" 10 mL时,c(H+,W)="=" 1 × 10-7mol/L |
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O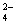 )>c(HC2O )>c(HC2O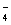 ) ) |
查看答案和解析>>
科目:高中化学 来源:2012届福建省高二下学期第一学段考试化学试卷 题型:选择题
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol·L-1 NaHC2O4溶液中滴加0.01 mol·L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH) = 0时,c(H+) = 1×10-2 mol·L-1
B.V(NaOH)<10 mL时,不可能存在c(Na+) = 2c(C2O42 -)+c(HC2O4- )
C.V(NaOH) = 10 mL时,c(H+) = 1×10-7 mol·L-1
D.V(NaOH)>10 mL时,c(Na+)>c(C2O42 -)>c(HC2O4- )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com