
ŅŃÖŖ25”ꏱ£¬Mg( OH)2µÄČܶȻż³£ŹżKsp=5.6 ”Įl0-12£®Č”ŹŹĮæµÄMgCl2ČÜŅŗ£¬¼ÓČėŅ»¶ØĮæµÄÉÕ¼īČÜŅŗ“ļµ½³ĮµķČܽāĘ½ŗā£¬²āµĆČÜŅŗµÄpH=13.0£¬ŌņĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®ĖłµĆČÜŅŗÖŠµÄc (H+) =10-13 mol£®L-1
B£®ĖłµĆČÜŅŗÖŠÓÉĖ®µēĄė²śÉśµÄc£ØOH -£©= 10£13 mol£®L-1
C£®ĖłµĆČÜŅŗÖŠµÄc (Mg2+) =5.6”Įl0-10 mol£®L-1
D£®Ėł¼ÓÉÕ¼īČÜŅŗµÄpH=13.0

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015¹ć¶«Ź”ø߶žĻĀѧʌµŚŅ»“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ»śĪļæÉŅŌŠĪ³ÉĖ³·“Ņģ¹¹µÄŹĒ
A£®±ūĻ© B£®2£¼×»ł£2£¶”Ļ©
C£®1£ĀČ£1£±ūĻ© D£®2£¬3£¶ž¼×»ł£2£¶”Ļ©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015øŹĖąŹ”ĢģĖ®ŹŠø߶žĻĀѧʌµŚŅ»“ĪŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
¹ŲÓŚĶ¬·ÖŅģ¹¹ĢåµÄŠšŹöÕżČ·µÄŹĒ
A£®Ļą¶Ō·Ö×ÓÖŹĮæĻąĶ¬¶ų½į¹¹²»Ķ¬µÄ»ÆŗĻĪļ»„³ĘĪŖĶ¬·ÖŅģ¹¹Ģå
B£®»ÆѧŹ½ĻąĶ¬¶ų½į¹¹²»Ķ¬µÄ»ÆŗĻĪļ»„³ĘĪŖĶ¬·ÖŅģ¹¹Ģå
C£®Ķ¬·ÖŅģ¹¹ĢåÖ®¼äÓÉÓŚ·Ö×Ó×é³ÉĻąĶ¬£¬ĖłŅŌĖüĆĒµÄŠŌÖŹĻąĶ¬
D£®Ö»ÓŠÉŁŹżµÄÓŠ»śĪļÖ®¼ä“ęŌŚĶ¬·ÖŅģ¹¹ĻÖĻó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğøŹĖąŹ”ĢģĖ®ŹŠĒŲ°²ĻŲøßČżµŚŅ»“ĪÄ£Äāæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠ·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹéŠ“ÕżČ·µÄŹĒ
A£®ŗ¬µČĪļÖŹµÄĮæµÄMgCl2”¢Ba(OH)2”¢HNO3ČżÖÖČÜŅŗ»ģŗĻ£ŗMg2+ + 2OH- = Mg(OH)2”ż
B£®CaCO3ČÜÓŚCH3COOH£ŗCaCO3 + 2CH3COOH = Ca2+ + 2CH3COO- + CO2”ü + H2O
C£®¹żĮæHIČÜŅŗ¼ÓČėµ½Fe(NO3)3ČÜŅŗÖŠ£ŗ2Fe3+ + 2I- = 2Fe2+ + I2
D£®SO2ĶØČėµ½äåĖ®ÖŠ£ŗSO2 + H2O + Br2 = 2H+ + SO42- + 2Br-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğøŹĖąŹ”øßČżµŚŅ»“ĪÕļ¶Ļæ¼ŹŌĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
[»Æѧ”Ŗ”ŖŃ”ŠŽ2£ŗ»ÆѧÓė¼¼Źõ](15·Ö)ijµŲĆŗķ·ŹÆ¾Ō¤“¦Ąķŗóŗ¬SiO2( 63%)”¢Al2O3( 25%) ”¢Fe2O3(5%)¼°ÉŁĮæøĘĆ¾µÄ»ÆŗĻĪļµČ£¬Ņ»ÖÖ×ŪŗĻĄūÓĆĆŗķ·ŹÆµÄ¹¤ŅÕĮ÷³ĢČēĻĀĶ¼ĖłŹ¾”£

£Ø1£©Š“³ö”°Ėį½ž”±¹ż³ĢÖŠÖ÷ŅŖ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ØČĪŠ“Ņ»øö£©£ŗ ”£
£Ø2£©ĪļÖŹX×ćĮæŹ±£¬”°×Ŗ»Æ”±¹ż³ĢÖŠ·¢Éś·“Ó¦µÄÓŠ¹ŲĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø3£©ŅŃÖŖFe3+æŖŹ¼³ĮµķŗĶ³ĮµķĶźČ«µÄpH·Ö±šĪŖ2.1ŗĶ3.7£¬A13+æŖŹ¼³ĮµķŗĶ³ĮµķĶźČ«µÄpH·Ö±šĪŖ4.1ŗĶ5.4”£ĪŖĮĖ»ńµĆAl( OH)3²śĘ·£¬“ÓĆŗķ·ŹÆµÄŃĪĖį½žČ”ŅŗæŖŹ¼£¬ČōÖ»ÓĆCaCO3Ņ»ÖÖŹŌ¼Į£¬ŗóŠųµÄ²Ł×÷¹ż³ĢŹĒ £¬Č»ŗóŌŁ¼ÓČėCaCO3£¬µ÷½ŚpHCaCO3ČōÖ»pHµ½5.4£¬¹żĀĖµĆµ½Al( OH)3 ”£
£Ø4£©ŅŌĆŗķ·ŹÆĪŖŌĮĻ»¹æÉŅŌæŖ·¢ĘäĖū²śĘ·£¬ĄżČēŌŚĆŗķ·ŹÆµÄŃĪĖį½žČ”Ņŗ³żĢśŗ󣬳£ĪĀĻĀĻņA1Cl3±„ŗĶČÜŅŗÖŠ²»¶ĻĶØČėHC1ĘųĢ壬æÉĪö³ö“óĮæA1Cl3”¤6H2O¾§Ģ唣½įŗĻ»ÆŃ§Ę½ŗāŅʶÆŌĄķ½āŹĶĪö³ö¾§ĢåµÄŌŅņ£ŗ ”£
£Ø5£©¹¤ŅµÉĻµē½āŅ±Į¶ĀĮµÄŌĮĻÓĆAl2O3¶ų²»ÓĆA1Cl3ĘäŌŅņŹĒ ”£µē½āAl2O3Ņ±Į¶ĀĮŹ±£¬Ńō¼«²ÄĮĻŹĒ £¬Ńō¼«ŠčŅŖ¶ØĘŚøü»»£¬ĘäŌŅņŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğøŹĖąŹ”øßČżµŚŅ»“ĪÕļ¶Ļæ¼ŹŌĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
A£®øß“æ¶ČµÄ¶žŃõ»Æ¹č¹ć·ŗÓĆÓŚÖĘ×÷¹āµ¼ĻĖĪ¬£¬¹āµ¼ĻĖĪ¬ÓöĒæ¼ī»į”°¶ĻĀ·”±
B£®Ćŗ¾¹żĘų»ÆŗĶŅŗ»ÆµČĪļĄķ±ä»ÆæÉŅŌ×Ŗ»ÆĪŖĒå½ąČ¼ĮĻ
C£®¶ąĢĒ”¢ÓĶÖ¬”¢µ°°×ÖŹ¾łÄÜ·¢ÉśĖ®½ā·“Ó¦
D£®½žÅŻ¹żøßĆĢĖį¼ŲČÜŅŗµÄ¹čŌåĶĮæÉŅŌĪüŹÕŅŅĻ©£¬ĖłŅŌæÉÓĆ“ĖĪļ±£ĻŹĖ®¹ū
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğ¹ć¶«Ź”ĮłŠ£ĮŖĆĖøßČżµŚČż“ĪĮŖæ¼ĄķæĘ×ŪŗĻ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
50”ꏱ£¬0.1mol”¤L£1Na2CO3ČÜŅŗpH£½12£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
A£®c(OH£)£½10£2mol”¤L£1
B£®¼ÓČėÉŁĮæNaOH¹ĢĢ壬c(Na£«)ŗĶc(CO32£)¾łŌö“ó
C£®c(Na£«)£«c(H£«)£½c(HCO3£)£«c(OH£)£«c(CO32£)
D£®2c(Na£«)£½c(HCO3£)£«c(CO32£)£«c(H2CO3)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğ°²»ÕŹ”ŗĻ·ŹŹŠøßČżµŚ¶ž“Ī½Ģѧ֏Įæ¼ģ²āĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
£Ø14·Ö£©Įņ“śĮņĖįÄĘŹĒŅ»ÖÖ³£¼ūµÄ»Æ¹¤ŌĮĻ£¬½«SO2ĶØČė°“Ņ»¶Ø±ČĄżÅä³ÉµÄNa2SŗĶNa2CO3µÄ»ģŗĻČÜŅŗÖŠ£¬±ćæɵƵ½Na2S2O3£¬ĘäÖʱø·“Ó¦·½³ĢŹ½ĪŖ£ŗ2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
£Ø1£©ŌŚÅäÖĘ»ģŗĻČÜŅŗĒ°ĻČ½«ÕōĮóĖ®¼ÓČČÖó·ŠŅ»¶ĪŹ±¼äŗó“żÓĆ£¬ĘäÄæµÄŹĒ ”£
£Ø2£©ÓĆøĆ·½·Ø»ńµĆµÄNa2S2O35H2O¾§ĢåÖŠ³£»ģÓŠŅ»¶ØĮæµÄŌÓÖŹ£¬Ä³ŠĖȤŠ”×éÓū¶ŌĘäÖŠĖłŗ¬ŌÓÖŹ³É·Ö½ųŠŠĢ½¾æ”£
”¾Ģį³ö¼ŁÉč”æøĆ¾§ĢåÖŠŗ¬ÓŠµÄŌÓÖŹæÉÄÜŹĒ£ŗNa2CO3”¢Na2SO3”¢_____”¢_____µČÖŠµÄŅ»ÖÖ»ņ¼øÖÖ£¬Čō¾§ĢåÖŠ»ģÓŠNa2SO3£¬ŌņÉś³ÉNa2SO3µÄ»Æѧ·½³ĢŹ½ĪŖ ”£
”¾ÅŠ¶ĻÓėĖ¼æ¼”æ
ijĶ¬Ń§Č”ÉŁĮæÖĘµĆµÄ¾§ĢåČÜÓŚ×ćĮæĻ”ĮņĖį£¬²¢½«²śÉśµÄĘųĢåĶØČėCuSO4ČÜŅŗÖŠ£¬Ī“¼ūŗŚÉ«³Įµķ£¬¾Ż“ĖČĻĪŖ¾§ĢåÖŠŅ»¶Ø²»ŗ¬Na2S£¬ÄćČĻĪŖĘä½įĀŪŹĒ·ńŗĻĄķ£æ_______ (Ģī”°ŗĻĄķ”±”¢”°²»ŗĻĄķ”±£©²¢ĖµĆ÷ĄķÓÉ£ŗ______________
”¾Éč¼Ę·½°ø½ųŠŠŹµŃé”æ
Čō¼ģŃ龧ĢåÖŠŗ¬Na2CO3£¬Ķź³ÉĻĀ±ķŹµŃé·½°ø”¢ĻÖĻó¼°½įĀŪ£ØŅĒĘ÷×ŌŃ”)”£
ĻŽŃ”ŹµŃéŹŌ¼Į£ŗ3mol/LH2SO4”¢1mol/LNaOHĖįŠŌKMnO4ČÜŅŗ”¢±„ŗĶNaHCO3ČÜŅŗ”¢Ę·ŗģČÜŅŗ”¢³ĪĒåŹÆ»ŅĖ®

£Ø3£©ŅŃÖŖ£ŗ2 Na2S2O3+I2=2NaI+Na2S4O6”£ĪŖ²ā¶ØĖłÖĘµĆ¾§ĢåµÄ“æ¶Č£¬øĆŠ”×éŅŌµķ·Ū×÷ÖøŹ¾¼Į£¬ÓĆ0.010mol/L µÄµāĖ®½ųŠŠ¶ą“ĪȔѳµĪ¶Ø£¬²āµĆNa2S2O35H2OµÄŗ¬ĮæŌ¼ĪŖ102%”£ČōĖłÓĆŹŌ¼Į¼°²Ł×÷¾łĪŽ²»µ±£¬²śÉśøĆ½į¹ū×īæÉÄܵÄŌŅņŹĒ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğ½ĖÕŹ”ĪŽĪżŹŠøßČżĘŚÄ©æ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(12·Ö)ļ®/Į×ĖįŃõĶµē³ŲŹĒŅ»ÖÖŅŌĮ×ĖįŃõĶ×÷ĪŖÕż¼«²ÄĮĻµÄļ®Ąė×Óµē³Ų£¬ĘäÕż¼«µÄ»īŠŌĪļÖŹŹĒCu4O(PO4)2£¬ÖʱøĮ÷³ĢČēĻĀ£ŗ
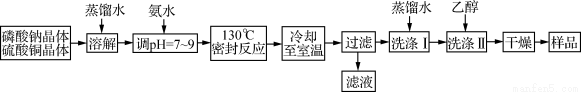
Ö÷ŅŖ·“Ó¦ŌĄķ£ŗ2Na3PO4£«4CuSO4£«2NH3”¤H2O===Cu4O(PO4)2”ż£«3Na2SO4£«(NH4)2SO4£«H2O
£Ø1£©ŹµŃéŹŅ½ųŠŠ”°¹żĀĖ”±²Ł×÷Ź¹ÓĆµÄ²£Į§ŅĒĘ÷Ö÷ŅŖÓŠ________”£
£Ø2£©Į÷³ĢÖŠ”°Ļ“µÓ¢ń”±ŗ󣬼ģŃé³ĮµķŅŃĻ“µÓøɾ»µÄ·½·ØŹĒ____________________”£
£Ø3£©øƵē³Ų·ÅµēŹ±£¬øŗ¼«ļ®×Ŗ»ÆĪŖLi2O£¬Õż¼«Į×ĖįŃõĶ×Ŗ±äĪŖCuŗĶLi3PO4£¬Š“³öøƵē³Ų·ÅµēŹ±µÄ»Æѧ·½³ĢŹ½____________________”£
£Ø4£©×¼Č·³ĘČ”ÉĻŹöĮ÷³ĢĖłµĆµÄѳʷ38.56 g[¼Ł¶Øѳʷ֊ֻŗ¬Cu4O(PO4)2ŗĶCuOĮ½ÖÖĪļÖŹ]£¬Ź¹ĘäĶźČ«ČÜÓŚŅ»¶ØĮæµÄĻõĖįÖŠ£¬ŌŁ¼ÓČėĒāŃõ»ÆÄĘČÜŅŗ£¬Ź¹ĶĶźČ«³Įµķ£¬½«³Įµķ×ĘÉÕŹ¹Ęä×Ŗ±äĪŖŗŚÉ«Ńõ»ÆĶ£¬×īÖÕ³ĘµĆ²ŠĮō¹ĢĢåÖŹĮæĪŖ27.20 g”£¼ĘĖćĖłµĆѳʷ֊Į×ĖįŃõĶµÄÖŹĮæ·ÖŹż”£(Š“³ö¼ĘĖć¹ż³Ģ)
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com