
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。
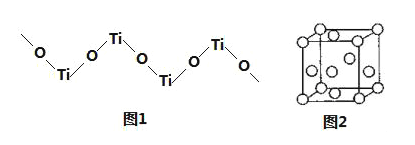
(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
【答案】 3d24s2 分子 sp3 CO2(或N2O、CS2、BeCl2等) Cl﹣、H2O [TiO]n2n+ ![]()
【解析】(1)Ti的原子序数为22,Ti原子核外有22个电子,根据构造原理书写其外围电子排布式。
(2)TiCl4的熔沸点较低,可溶于苯或CCl4等非极性溶剂,TiCl4晶体属于分子晶体。BH4-中中心原子B上的孤电子对数=![]() (3+1-4
(3+1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
(3)用“替换法”书写等电子体。
(4)绿色晶体的化学式为[TiCl(H2O)5]Cl2·H2O,绿色晶体的配体为Cl-和H2O。
(5)根据结构,其中Ti与O之比为1:1,Ti元素的化合价为+4价,O元素的化合价为-2价,钛酰离子的化学式为[TiO]n2n+。
(6)由晶体的密度和1mol晶体的质量计算1mol晶体的体积,用“均摊法”确定晶胞中粒子的个数,计算晶胞的体积,应用几何知识计算晶胞的边长。
(1)Ti的原子序数为22,Ti原子核外有22个电子,根据构造原理,基态Ti原子的核外电子排布式为1s22s22p63s23p63d24s2,Ti的基态原子的外围电子排布式为3d24s2。
(2)TiCl4的熔沸点较低,可溶于苯或CCl4等非极性溶剂,TiCl4晶体属于分子晶体。BH4-中中心原子B上的孤电子对数=![]() (3+1-4
(3+1-4![]() 1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
1)=0,成键电子对数为4,价层电子对数为0+4=4,B原子为sp3杂化。
(3)用“替换法”,与CNO-互为等电子体的分子的化学式为CO2、N2O、CS2、BeCl2等。
(4)绿色晶体的化学式为[TiCl(H2O)5]Cl2·H2O,绿色晶体的配体为Cl-和H2O。
(5)根据结构,其中Ti与O之比为1:1,Ti元素的化合价为+4价,O元素的化合价为-2价,钛酰离子的化学式为[TiO]n2n+。
(6)1mol金属Ti的质量为48g,1mol金属Ti的体积为48g![]() ρg/cm3=
ρg/cm3=![]() cm3;用“均摊法”,1个晶胞中含Ti的个数为8
cm3;用“均摊法”,1个晶胞中含Ti的个数为8![]() +6
+6![]() =4;晶胞的体积为
=4;晶胞的体积为![]() cm3
cm3![]() NA
NA![]() 4=
4=![]() cm3;晶胞的边长为
cm3;晶胞的边长为![]() cm。
cm。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某些有机物质的分子式采取适当变形会简化计算.下列计算中错误的是( )
A. 等质量的甲烷、乙烯、乙炔充分燃烧,消耗的氧气的物质的量依次增多
B. Wg葡萄糖充分燃烧后,燃烧产物经过足量的Na2O2充分反应,固体质量增加Wg
C. 乙酸和两种链状单烯烃混合物中氧的质量分数为a,则碳的质量分数是6/7(1-a)
D. 等物质的量的乙醇与丙烯酸![]() 充分燃烧,消耗的氧气的物质的量相同
充分燃烧,消耗的氧气的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应如下:3H2+N2![]() 2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
2NH3。某温度下,在容积恒定为2.0 L的密闭容器中充入2.0 mol N2和2.0 mol H2,一段时间后反应达平衡状态,实验数据如下表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)0~50 s内的平均反应速率 v(N2)=_______________。
(2)250 s时,H2的转化率为_______________。
(3)已知N≡N的键能为946 kJ·mol-1,H-H的键能为436 kJ·mol-1,N-H的键能为391 kJ·mol-1,则生成1 mol NH3过程中的热量变化为_______kJ。下图能正确表示该反应中能量变化的是_____(填字母)。
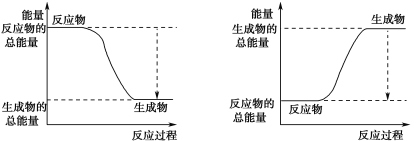
A B
(4)为加快反应速率,可以采取的措施______________。
a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离出NH3
(5)下列说法错误的是____________。
a.使用催化剂是为了加快反应速率,提高生产效率
b.上述条件下,N2不可能100%转化为NH3
c.在一定条件下,合成氨反应有一定的限度
d.250~350 s时,生成物浓度保持不变,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关纤维素的说法,错误的是( )
A.纤维素能水解生成葡萄糖
B.纤维素在人体内能够被消化吸收
C.纤维素是一种天然高分子化合物
D.纤维素是纤维状结构的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究影响化学反应速率的因素时,将H2C2O4溶液滴入KMnO4酸性溶液中,一段时间后,溶液突然变成无色,发生反应:KMnO4+H2C2O4+H2SO4![]() K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
A. H2C2O4中C的化合价为+3
B. 每生成22.4 L(标况)CO2,转移电子2 mol
C. 该反应中,氧化剂与还原剂物质的量之比为2 :5
D. 溶液突然褪色的原因是产物MnSO4对该反应有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将乙烯分别通过如图所示的装置,下列叙述正确的是( )

A. 二者都褪色且原理相同
B. 二者都能证明乙烯中有碳碳双键
C. 二者都可用于除去乙烷中混有的乙烯
D. 二者都可用于鉴别乙烷和乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是( )
A. 光照射甲烷与氯气的混合气体 B. 乙烯通入溴水中
C. 在镍做催化剂的条件下,苯与氢气反应 D. 苯燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属吸热反应的是( )
A. Zn与稀硫酸反应放出氢气 B. 酸碱中和反应
C. 硫在空气或氧气中燃烧 D. Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com