
| A. | 4种 | B. | 8种 | C. | 10种 | D. | 12种 |
分析 根据烷基组成通式结合式量为57的确定烷基,再根据烷烃的同分异构体中等效氢确定烷基同分异构体数目,利用等效H判断甲苯苯环上的H原子种类有3种,再利用组合计算判断.
解答 解:烷基组成通式为CnH2n+1,烷基式量为57,所以14n+1=57,解得n=4,所以烷基为-C4H9,
若为正丁烷形成的丁基,正丁烷分子中有2种H原子,形成的丁基有2种结构,
若为异丁烷形成的丁基,异丁烷分子中有2种H原子,形成的丁基有2种结构,
故丁基共有4种结构,
甲苯苯环上的H原子种类有3种,故丁基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为4×3=12,
故选:D.
点评 本题主要考查同分异构体的书写,难度中等,关键根据烷基式量为57的确定烷基,注意利用等效氢判断可能的烷基异构情况与苯环中氢原子种类,利用组合计算.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性氧化物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 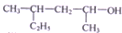 的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{238}$Pu的质子数为94,中子数为238,电子数为144 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2可用于加工食品,使食品增白 | |
| B. | NaOH可用于清洗抽油烟机 | |
| C. | 葡萄糖可用于合成保健药物维生素C | |
| D. | 聚丙烯塑料可用作食品保鲜膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
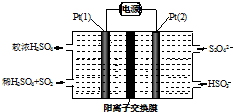 工业尾气SO2有多种吸收和处理方法.
工业尾气SO2有多种吸收和处理方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
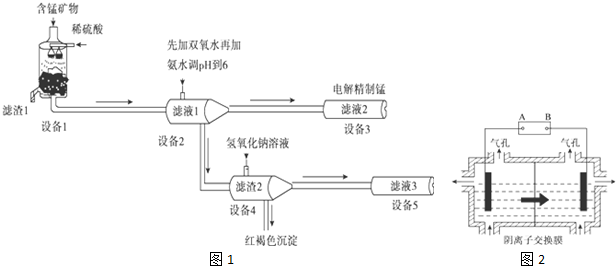
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
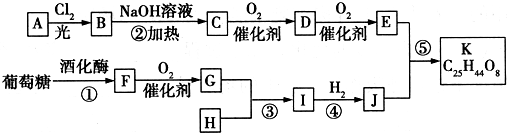
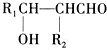
 ;G:CH3CHO.
;G:CH3CHO.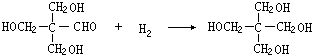 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用浓硝酸与Cu反应制NO2 | B. | 实验室用NH4Cl和Ca(OH)2制备NH3 | ||
| C. | NO2溶于水时发生氧化还原反应 | D. | 过量的铜与浓硝酸反应有N0生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是AlCl3溶液 | |
| B. | 若一支试管中只产生沉淀,一支试管中无明显现象时,则滴加的是H2SO4 | |
| C. | 若两支试管中都只产生白色沉淀时,则滴加的是Ba(0H)2溶液 | |
| D. | 若两支试管中既产生沉淀又出现气体时,则滴加的是NH4HCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
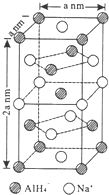 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com