
正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法正确的是( )
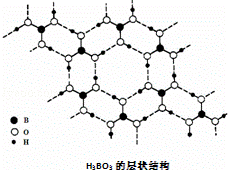
|
| A. | 正硼酸晶体中只存在氢键 |
|
| B. | H3BO3分子的稳定性与氢键无关 |
|
| C. | 分子中硼原子最外层为8e﹣稳定结构 |
|
| D. | 含1molH3BO3的晶体中有6mol氢键 |
考点:
不同晶体的结构微粒及微粒间作用力的区别;含有氢键的物质.
专题:
化学键与晶体结构.
分析:
A.H3BO3分子内存在共价键;
B.分子的稳定性与化学键有关;
C.由B原子的结构可知,硼原子最外层只有3个电子,与氧原子形成3对共用电子对;
D.利用均摊法计算含1molH3BO3的晶体中的氢键.
解答:
解:A.H3BO3分子内存在共价键,H3BO3分子之间存在氢键,故A错误;
B.分子的稳定性与分子内的B﹣O、H﹣O共价键有关,熔沸点与氢键有关,故B正确;
C.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e﹣稳定结构,故C错误;
D.一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,故D错误;
故选B.
点评:
本题考查了微粒间作用力的判断断、影响分子稳定性的因素等知识点,难度不大,注意分子的稳定性与化学键有关,物质的熔沸点与氢键有关.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
在100℃时,将0.40mol的二氧化氮气体充入2L真空的密闭容器中,每隔一段时间就对该容器内的物质进行分析,得到数据如表所示:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为 mol•L﹣1•s﹣1.
(2)n3 n4(填“>”、“<”或“=”),该反应的平衡常数为 (保留小数点后一位).
(3)若在相同情况下,最初向该容器中充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是 mol•L﹣1,假设在80s时达到平衡,请在如图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(4)达到平衡后,如升高温度,气体颜色会变深,则升高温度后,反应2NO2(g)⇌Ν2O4(g)的平衡常数将 (填“增大”、“减小”或“不变”).
(5)达到平衡后,如向该密闭容器中再充入0.32mol氦气,并把容器体积扩大为4L,则平衡将 (填“向左移动”、“向右移动”或“不移动”).

查看答案和解析>>
科目:高中化学 来源: 题型:
过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:正确的操作顺序是( )
①加入稍过量的Na2CO3溶液;
②加入稍过量的NaOH溶液;
③加入稍过量的BaCl2溶液;
④滴入稀盐酸至无气泡产生;
⑤过滤.
A. ③②①⑤④ B. ①②③⑤④ C. ②③①④⑤ D. ③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,既有共价键的断裂,又有离子键的形成的是( )
|
| A. | 盐酸和氢氧化钠溶液反应 |
|
| B. | 氯化氢气体溶解于水 |
|
| C. | 氯化氢气体遇到氨气产生“白烟” |
|
| D. | 锌片投入稀硫酸中产生气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
肯定属于同族元素且性质相似的是( )
|
| A. | 原子核外电子排布式:A为1s22s2,B为1s2 |
|
| B. | 结构示意图:A为 |
|
| C. | A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子 |
|
| D. | A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、E为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高.E原子外围未成对电子数是同周期中最多的.W元素的电离能数据见下表(kJ•mol﹣1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
请回答:
(1)E元素基态原子的价电子排布式是: ,周期表中位置 ;
(2)X、Y、Z、W四种元素的电负性大小关系: (填元素符号,用“>”连接);
(3)写出W2Y2的电子式 ;
(4)X、Z可以形成一种共价化合物,其中两种元素最外层电子数都达到8,则其分子的空间构型是: ;
(5)X的氢化物易溶于水的原因是:
(6)用氢键表示式写出Z的氢化物水溶液中可能存在的氢键 .
(7)肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
|
| A. | CO2的摩尔质量为44 g |
|
| B. | 1 mol N2的质量是14 g |
|
| C. | 等质量的水与质量分数98%L的硫酸混合所得溶液的质量分数大于49% |
|
| D. | 标准状况下,1 mol CO2所占的体积约是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一固体混合物,可能由Na2CO3、CaCO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成.为检验它们,做了以下实验:
(1)将固体混合物溶于水,搅拌后得无色透明溶液;
(2)往此溶液中滴加过量的硝酸钡溶液,有白色沉淀生成;
(3)过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解.
试判断:
①固体混合物中肯定有 ,
②肯定没有 ,
③可能有 N ;
对可能有的物质,可采取向滤液中滴加 溶液的方法来检验.
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径和主要化合价见表,下列有关说法中,正确的是( )
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、﹣2 | +7、﹣1 | +2 | ﹣2 |
|
| A. | 等物质的量的X、Y的单质与足量盐酸反应,生成H2一样多 |
|
| B. | Y与Q形成的化合物不可能跟氢氧化钠溶液反应 |
|
| C. | Z的氢化物的稳定性强于L的氢化物的稳定性 |
|
| D. | 与稀盐酸反应的剧烈程度:M单质<X单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com