
下列说法不正确的是( )
|
| A. | H2O的沸点比H2S的沸点高是因为O的非金属性比S的非金属性强 |
|
| B. | F2、Cl2、Br2、I2的沸点依次升高是因为它们分子间作用力依次增大 |
|
| C. | 离子化合物溶于水时离子键被破坏,共价化合物溶于水时共价键不一定改变 |
|
| D. | 只含共价键的物质不一定属于共价化合物 |
| 元素周期律和元素周期表的综合应用;元素周期律的作用. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | A.水分子之间含氢键,沸点高; B.F2、Cl2、Br2、I2均为分子晶体,其沸点与分子间作用力有关; C.电离时化学键断裂,若不电离,则化学键不变; D.共价键可存在于单质、共价化合物中. |
| 解答: | 解:A.水分子之间含氢键,沸点高,则H2O的沸点比H2S的沸点高,故A错误; B.F2、Cl2、Br2、I2均为分子晶体,其沸点与分子间作用力有关,则相对分子质量逐渐增大,可知分子间作用力依次增大,沸点依次增大,故B正确; C.电离时化学键断裂,若不电离,则化学键不变,则离子化合物溶于水时离子键被破坏(如NaCl),共价化合物溶于水时共价键不一定改变(如HCl破坏、乙醇不破坏),故C正确; D.共价键可存在于单质(H2等)、共价化合物(HCl等)中,即只含共价键的物质不一定属于共价化合物,可能为单质,故D正确; 故选A. |
| 点评: | 本题考查较综合,涉及沸点比较、化学键及化合物的关系等,把握规律性知识及应用为解答的关键,侧重分析与应用能力的考查,题目难度不大. |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
下列各组中的反应,属于同一反应类型的是( )
|
| A. | 乙烯水化制乙醇;溴乙烷水解制乙醇 |
|
| B. | 甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色 |
|
| C. | 甲苯硝化制TNT;乙烯氧化制乙醛 |
|
| D. | 乙醇脱水制乙烯;溴乙烷消去制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示进行实验,下列说法正确的是( )
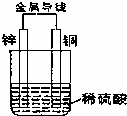
|
| A. | 铜片上冒气泡,该气体是H2,铜片是正极,该装置是原电池 |
|
| B. | 锌片质量减小,锌片是负极,发生还原反应 |
|
| C. | 电子流向:锌→导线→铜→稀硫酸→锌,形成一个闭合回路 |
|
| D. | 溶液中的阳离子移向负极,阴离子移向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于现有元素周期表的说法不正确的是( )
|
| A. | 编排的总原则是按元素的核电荷数递增的顺序排列,且将电子层数相同的元素排成同一行,将最外层电子数相同的排成同一列 |
|
| B. | 一个族就是一列,一个周期就是一个横行 |
|
| C. | 指导人们在金属与非金属元素的分界线附近寻找半导体材料 |
|
| D. | 指导人们在过渡元素中寻找合适的有机反应的催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两容器中均进行反应:N2+3H2⇌2NH3,在相同时间内,甲容器中断裂1molN≡N键且同时形成3molH﹣H键,乙容器中断裂0.5molN≡N键且同时断裂3molN﹣H键,下列说法正确的是( )
|
| A. | 甲容器中的反应速率一定大于乙容器中的反应速率 |
|
| B. | 甲容器中的反应速率可能小于乙容器中的反应速率 |
|
| C. | 无法判断两容器中的上述反应是否都达到了平衡状态 |
|
| D. | 上述两容器中的反应一定是在相同温度和相同压强下进行的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下容积为10L的密闭容器中加入一定量的SO2、O2并发生如下反应:2SO2(g)+O2(g)⇌2SO3(g),经过10分钟测得容器中三种物质SO2、O2、SO3的物质的量分别为3mol、9mol、2mol,再经过t分钟时反应达到了平衡状态,且已知平衡状态时SO2的转化率为80%(提示:SO2的转化率是指反应掉的SO2占原来SO2总量的百分数),回答下列问题:
(1)前10分钟SO2的平均反应速率为 ,10分钟时该反应是否达到平衡状态
(填“是”、“否”、“不一定”),开始时加入容器中的O2的物质的量为 ;
(2)平衡状态时容器中O2的浓度为 ,关于t分钟的下列说法正确的是 ;
A.t肯定大于10
B.t肯定小于10
C.t一定等于10
D.t可能大于10、也可能等于或小于10
(3)改变温度化学平衡发生移动,最后重新达到新的平衡状态,在新平衡状态下测得各物质的浓度数据如下,其中合理的是 ;
A.c(SO2)=0.2mol/L,c(O2)=0.8mol/L,c(SO3)=0.3mol/L
B.c(SO2)=0.2mol/L,c(O2)=0.85mol/L,c(SO3)=0.3mol/L
C.c(SO2)=0.2mol/L,c(O2)=0.8mol/L,c(SO3)=0.4mol/L
D.c(SO2)=0.05mol/L,c(O2)=0.775mol/L,c(SO3)=0.35mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是( )
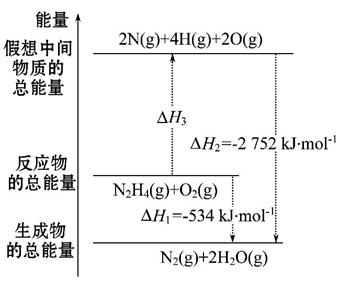
A.194 B.391 C.516 D.658
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 1mol任何气体的体积一定是22.4L |
|
| B. | 标准状况下,22.4L任何气体所含分子数都约为6.02×1023个 |
|
| C. | 在标准状况下,体积为22.4L的物质都是1mol |
|
| D. | 在非标准状况下,1mol任何气体的体积不可能是22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com