
【题目】锂电池由于能量密度大逐渐取代锌电池。常用锂电池的正极材料为磷酸亚铁锂(LiFe-PO4),可采用FeCl3、NH4H2PO4、LiCl和苯胺等原料制备。回答下列问题:
(1)Fe基态原子核外电子排布式为___。
(2)已知Li2O是离子晶体,其晶格能的Born-Haber循环如图所示。
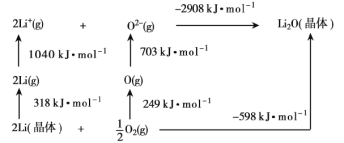
如图可知,Li原子的第一电离能为___kJ·mol-1,O=O键键能为___kJ·mol-1,Li2O晶格能为__kJ·moL-1。
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为___,其中Fe的配位数为___。
(4)NH4H2PO4中,P的杂化轨道类型为___。
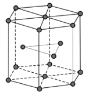
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为___。六棱柱底边边长为a cm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为___g·cm-3(列出计算式即可)。
【答案】1s22s22p63s23p63d64s2 520 498 2908 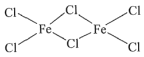 4 sp3 六方最密堆积
4 sp3 六方最密堆积 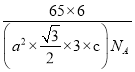
【解析】
(1)基态Fe原子核外电子数为26;
(2)Li原子的第一电离能为Li原子失去1个电子所需要的能量;O=O键键能为氧气分子变为氧原子所需能量;晶格能是气态离子形成1mol离子晶体释放的能量;
(3)蒸汽状态下以双聚分子存在的FeCl3,存在Fe-Cl键;
(4)磷酸根离子中P形成4个σ键;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=![]() 。
。
(1)Fe基态原子核外电子排布式为1s22s22p63s23p63d64s2;
(2)Li原子的第一电离能为Li原子失去1个电子所需要的能量,所以其第一电离能为![]() kJ/mol=520kJ/mol;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ/mol=498kJ/mol;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ/mol;
kJ/mol=520kJ/mol;O=O键键能为氧气分子变为氧原子所需能量,其键能=2×249kJ/mol=498kJ/mol;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ/mol;
(3)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为 ,Fe原子周围有4个Cl,则其中Fe的配位数为4;
,Fe原子周围有4个Cl,则其中Fe的配位数为4;
(4)NH4H2PO4中,磷酸根离子中P形成4个σ键,则P的杂化轨道形式为sp3;
(5)金属锌的这种堆积方式称为六方最密堆积,该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=
+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(a×a×sin120°)×3×c]cm3,晶胞密度=![]() =
=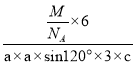 g/cm3=
g/cm3=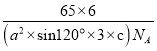 g/cm3或
g/cm3或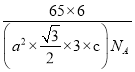 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断不正确的是
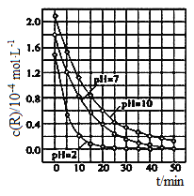
A. 在0~20min之间,pH=7时R的降解速率为7×10-6mol·L-1·min-1
B. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
C. 在这三种pH条件下,二氧化钛对pH=2的R溶液催化降解效率最好
D. 在0~50 min之间,R的降解百分率pH=2等于pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒等果酒易发生变质,常加入抗氧化剂。如图是一种抗氧化剂的制取装置。实验前已除尽装置内的空气,实验后装置Ⅱ中有Na2S2O5晶体析出。
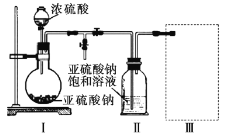
(1)实验前除尽装置内空气的原因是___。
(2)装置Ⅰ中的玻璃仪器的名称___。
(3)要从装置Ⅱ中获得纯净的晶体,操作方法是___。
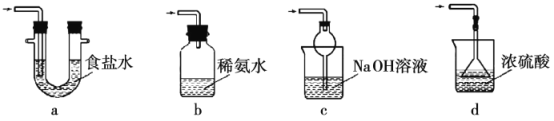
(4)下列可用于装置Ⅲ的为___(填序号)。
(5)设计实验证明Na2S2O5晶体在空气中可能被氧化,实验方案是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
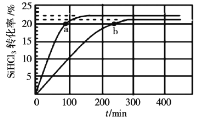
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。
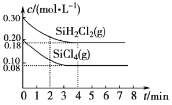
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。
Ⅰ.羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)![]() Ni(CO)4(g) ②Ni(CO)4(g)
Ni(CO)4(g) ②Ni(CO)4(g)![]() Ni(S)+4CO(g)
Ni(S)+4CO(g)
完成下列填空:
(1)在上述反应中断裂或形成的化学键有____(填序号)。
A.离子键 B.配位键 C.非极性共价键 D.金属键
(2)比较C元素和O元素分别形成的最简单气态氢化物的稳定性大小________。
(3)C、O、Ni元素的电负性由大到小排列顺序为______。
(4)化合物Ni(CO)4呈正四面体构型,Ni(CO)4中Ni原子的杂化类型为____。
(5)基态Ni原子的外围电子排布式___,价电子的轨道表示式为__________。
Ⅱ.研究金属镍及其化合物晶体结构具有重要意义。
(6)NiO、FeO的晶体结构类型均与氯化钠的相同,且Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO_______FeO(填“<”或“>”);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X为中学化学常见物质,A、B、C含有相同元素甲,可以发生如下转化(水参与的反应,水未标出)。
![]()
下列说法不正确的是
A.若A、B、C的焰色反应呈黄色、水溶液均呈碱性,则X可以是CO2
B.若C为红棕色气体,则A一定为空气中含量最高的气体
C.若B为FeCl3,则X一定是Fe
D.A可以是碳单质,也可以是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A. 相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
C. ①、④两溶液等体积混合,所得溶液中c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D. VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com