
| A. | 煤的干馏,石油的裂化和裂解均属于化学变化 | |
| B. | 利用铝热反应可以冶炼Fe、Cr、Mn、W、Na等金属 | |
| C. | 甲烷和氯气制备一氯甲烷的原子利用率可达100% | |
| D. | SO2、NO2、CO2均是导致酸雨的主要原因 |
分析 A.根据是否有新物质生成判断是物理变化还是化学变化;
B.利用铝热反应可以冶炼熔点较高的金属如钒、铬、锰等,钠不属于熔点较高的金属;
C.原子的利用率为100%;即生成物质只有一种;
D.酸雨与二氧化硫、氮的氧化物等有关,它们与水反应生成酸,使雨水酸性增强,形成酸雨.
解答 解:A.煤的干馏是指将煤隔绝空气加强热使之分解的过程,有新物质生成,属于化学变化;通过石油的裂化、裂解可以得到小分子化合物,所以石油的裂化、裂解是化学变化,故A正确;
B.钠不属于熔点较高的金属,通常用电解的方法制取,利用铝热反应可以冶炼Fe、Cr、Mn、W等熔点较高的金属,故B错误;
C.甲烷和氯气发生取代反应制备一氯甲烷,同时还有氯化氢生成,产物有两种,不符合“原子利用率可达100%”的思想,故C错误;
D.SO2、NO2均是导致酸雨的主要原因,CO2与温室效应有关,不是导致酸雨的主要原因,故D错误;
故选A.
点评 本题考查化学变化的辨别、金属的冶炼方法、绿色化学、酸雨的成因等知识,题目难度不大,注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z>W | |
| B. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Li、Na、K、Rb单质的密度依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
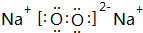
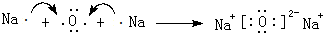 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
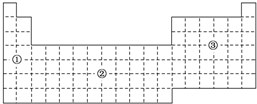 如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )
如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )| A. | ①区、③区、③区 | B. | ①区、③区、②区 | C. | ①区、②区、②区 | D. | ②区、③区、③区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
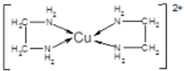
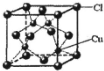 ,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.
,其中Cl-的配位数为4,已知晶胞的棱长为dcm,用NA表示阿伏加德罗常数值,则晶胞的密度表达式为$\frac{396}{{d}^{3}•{N}_{A}}$g/cm3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com