
| �������� | Fe3+ | Fe2+ | Cu2+ | |
| pH | �������↑ʼ���� | 1.9 | 7.0 | 4.7 |
| �������ﰲȫ���� | 3.2 | 9.0 | 6.7 | |
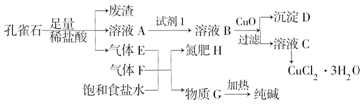
���� ���ȸʯ�м�������ϡ���ᣬ�����ķ�Ӧ��Cu2��OH��2CO3+4HCl=2CuCl2+3H2O+CO2������ҺAֻ��Cu2+��Fe2+��Fe3+���ֽ������ӣ���������������ϡ�����������Ρ������κ�ˮ��Ȼ����˵õ��������к���Si���������ҺA�к��к������κ������μ�CuCl2������EΪCO2��������CO2������F�ͱ���ʳ��ˮ��ϵõ�����H������G������Ԫ���غ�֪FΪNH3������HΪNH4Cl������G�õ������GΪNaHCO3������ҺA�м����Լ�1�õ���ҺB������ҺB�м���CuO�����˵õ���ҺC�ͳ���D������ҺC���ܵõ�CuCl2.3H2O�������DӦ�ú�����Ԫ�أ�CuO��Ŀ���ǵ�����Һ��pH��ʹFe 3+ת��ΪFe��OH��3����������Ԫ���غ�֪��B�к���Fe3+��Cu2+�����Լ�1��Ŀ���ǽ�Fe2+ת��ΪFe3+�Ҳ����������ʣ�Ӧ��ѡȡ˫��ˮ����ˮ���ݴ˷������
��� �⣺��1���������Ϸ������Լ�1��Ŀ���ǽ�Fe2+ת��ΪFe3+�Ҳ����������ʣ�Ӧ��ѡȡ˫��ˮ����ˮ���ʴ�Ϊ��Cl2����H2O2����
��2������������ȫ������Fe3+pHΪ3.2���������↑ʼ����Cu2+pHΪ4.7������CuO�����ǵ�����ҺpH��ʹFe3+ת��Ϊ�������Է��룬�Ҳ��ܳ���������ͭ����������pHȡֵ��ΧΪ3.2��pH��4.7��
�ʴ�Ϊ��3.2��pH��4.7��
��3������E�Ƕ�����̼��F�ǰ�����̼������С�����ᣬ���Զ�����̼�����ڱ����Ȼ�����Һ��������������ˮ������Ӧ����ͨ��F��ΪNH3�����������̼���ܽ⣬�Ӷ�����̼�����ƺ��Ȼ�泥��ʴ�Ϊ��F��NH3��
��4������Һ�л�ȡ���壬Ӧ�ò�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ķ����õ��ϴ����ľ��壬�ʴ�Ϊ������Ũ������ȴ�ᾧ��
���� ���⿼�������Ʊ������ʷ�����ᴿ��Ϊ�߿���Ƶ�㣬���ؿ���ѧ�����������㼰ʵ������������ؼ�����ȷʵ��ԭ������������������֪������ͼ�з����ķ�Ӧ�����������ǽ��Ĺؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 11.2 Lһ����̼�к��еķ���������0.5NA | |
| B�� | 1mol FeCl3�Ƶõ��������������к�������ΪNA | |
| C�� | 32g��������������ĿΪ16NA | |
| D�� | 0.5L 2mol/L�����к��е�HCl������ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ˮָ��������Ϊ0.9%��NaCl��Һ | |
| B�� | 1L 0.2mol/L��������Һ�к��е�SO42-��������Ϊ0.2NA | |
| C�� | 1L 1 mol/L K2CO3��Һ�к��еļ�������ĿΪNA | |
| D�� | 0.1 mol/L BaCl2��Һ�У�Cl-�����ʵ���Ũ��Ϊ0.1 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ƹ���������Ͷ�š�������ա����ദ�� | |
| B�� | ������ֲ���Ӫ��Ԫ�أ��������������������ˮֱ���ŷ� | |
| C�� | ʹ��������̫���ܡ����ܵ���Դ���洫ͳ��ú̿ | |
| D�� | ���ƿ���ȼ�ϵ�����������ٻ�����β����Ⱦ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ��һ��10���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
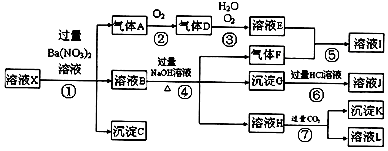
��A��B��C��D��E���ֳ���������������±��е������γɵģ�
������ | K+ Na+ Cu2+ Al3+ |
������ | SO42�� HCO3�� NO3�� OH�� |
Ϊ�˼�������������ֱ��������ʵ�飬�����ǣ�
�ٽ���������ˮ��DΪ��ɫ��Һ��������Ϊ��ɫ��Һ��
�ڽ�E ��Һ���뵽C��Һ�г��ְ�ɫ�����������μӣ������ܽ⣻
��Һ���뵽C��Һ�г��ְ�ɫ�����������μӣ������ܽ⣻
�۽�����ɫ��Ӧ��ֻ��BΪ��ɫ������ɫ�ܲ�������
���ڸ���Һ�м������ᱵ��Һ���ټӹ���ϡ���ᣬA�зų���ɫ���壬C��D�в�����ɫ������
�ݽ�B��D����Һ��ϣ�δ���������������ɡ�
��������ʵ����գ�
��1��д��B��D�Ļ�ѧʽ��B ��D ��
��2������1mol A����Һ�뺬1m ol E����Һ��Ӧ�����ɣ����õ�һ�ֻ�����û�����Ļ�ѧʽΪ ��
ol E����Һ��Ӧ�����ɣ����õ�һ�ֻ�����û�����Ļ�ѧʽΪ ��
��3����A��Һ�м�����������ʯ��ˮ�������ӷ���ʽΪ ��
��4��C��������ˮ���������ӷ���ʽ��ʾ�侻ˮԭ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com