
 在5L的密闭容器中进行下述反应4NH3(g)+5O2(g)
在5L的密闭容器中进行下述反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g) 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )
4NO(g)+6H2O(g) 30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是( )
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
科目:高中化学 来源: 题型:
化学家将研究气体与固体(或液体)在界面上所发生的物理化学现象的科学称为表面化学。对下列现象的研究不属于表面化学范畴的是( )
A.氯化银在水中的溶解平衡
B.氢氧燃料电池中电极上的反应
C.铁在潮湿的空气中生锈
D.氮气与氢气在铁触媒作用下化合
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B两种烃,所含碳元素的质量分数相同,关于A和B叙述中正确的是( )
A.二者不可能是同系物
B.二者一定是同分异构体
C.二者最简式相同
D.将等质量的A和B分别燃烧生成CO2的质量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如下图所示。请回答下列问题:
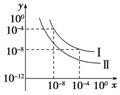
(1)曲线Ⅰ代表的温度下,水的离子积为________,曲线Ⅰ所代表的温度________(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是____________________________________________。
(2)曲线Ⅰ所代表的温度下,0.01 mol/L的NaOH溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
航天飞机用铝粉和高氯酸铵(NH4ClO4)的混合物作为固体燃料,点燃时铝粉氧化并放出大量热量引发高氯酸铵分解:NH4ClO4=N2↑+Cl2↑+2O2↑+4H2O。下列对此反应叙述不正确的是( )
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.上述反应从能量变化上说,主要是化学能转化为热能和动能
D.该反应中高氯酸铵只起氧化剂作用
查看答案和解析>>
科目:高中化学 来源: 题型:
往一个容积为5L的密闭容器中,通入2molN2和3molH2,在一定条件下,发生反应 N2+3H2 2NH3,2 min后测得容器中生成了1mol NH3,试求:
2NH3,2 min后测得容器中生成了1mol NH3,试求:
(1)2 min时,N2的物质的量 ;
(2) 2 min时,H2的物质的量浓度 ;
(3)2 min时,H2的转化率 ;
(4)2min内,N2的平均反应速率 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应A2(g) + 2B2(g)  2AB2(g) △H<0,下列说法正确的是( )
2AB2(g) △H<0,下列说法正确的是( )
A.升高温度,正反应速率增加,逆反应速率减小
B.增大压强能使正、逆反应速率都增大,但有利于平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源。
(1)已知 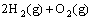 =2H2O(g) △H=- 483.6 kJ/mol
=2H2O(g) △H=- 483.6 kJ/mol
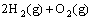 =2H2O(l) △H=-571.6 kJ/mol
=2H2O(l) △H=-571.6 kJ/mol
 |
=H2O(l) △H=-285.8 kJ/mol
氢气的燃烧热是 kJ/mol
(2)人们可以通过多种途径获取氢气。
①1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
②工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g),已知在25℃时:
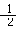 H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
H2 (g) + O2 (g) = H2O(g) △H=-242 kJ/mol
C(石墨)+O2(g)== CO2(g) △H=-394 kJ/mol
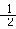 C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
C(石墨)+ O2(g)== CO(g) △H=-111 kJ/mol
则25℃时一氧化碳与水蒸气作用转化成氢气和二氧化碳反应的△H= kJ/mol 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com