
【题目】下列说法不正确的是
A. 氯气可用于自来水的消毒 B. 镁可用于制造信号弹和焰火
C. 氢氧化铁胶体能用于净水 D. 二氧化硫不可用于漂白纸浆
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛。下列反应不属于氧化还原反应的是
A. 木炭燃烧:C + O2![]() CO2
CO2
B. 煅烧石灰石:CaCO3 ![]() CaO + CO2 ↑
CaO + CO2 ↑
C. 铁的冶炼:Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
D. 电解水: 2H2O ![]() 2 H2 ↑ + O2 ↑
2 H2 ↑ + O2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】腐乳是桂林有名的特产之一,请参考图中的有关信息回答下列问题。

(1)制作腐乳的主要原料是黄豆,黄豆富含人体所需的营养物质主要是_______。制作腐乳用到了加碘盐,即在食盐中加入_______(写出碘化合物的名称或化学式)。
(2)腐乳在酿制过程中会产生多种氨基酸,故味道鲜美,这些氨基酸的通式为________。腐乳虽好但不能作为主食,原因在于腐乳所含的_______类营养素较少,而该类营养素是人类生命活动所需能量的主要来源物质。
(3)盛装腐乳的陶罐属于_______(填“无机”或“有机”)非金属材料制品,陶罐的主要成分为_______酸盐。
(4)外包装纸盒所用纸的主要成分是____________。包装盒提绳的主要成分是聚丙烯塑料,由丙烯合成聚丙烯的化学方程式为:_____________________________。
(5)聚丙烯等材料制成的塑料制品不应随意丢弃,以免造成俗称“_________污染”的环境问题。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SOCl2(亚硫酰氯)是一种无色或淡黄色发烟液体,遇水或醇生成二氧化硫和氯化氢,用途非常广泛。已知:SO2+Cl2+SCl2=2SOCl2。
(1)SCl2的电子式为___________。
(2)上述SOCl2的制备反应中,生成1molSOCl2时转移________mol电子。
(3)SOCl2与足量NaHCO3溶液反应的离子方程式为____________。
(4)无水AlCl3是有机反应的催化剂,也是制取无水四氯铝酸锂(LiAlCl4)的原料,可由AlCl3溶液浓缩结晶得到AlCl3·6H2O,再脱水得到AlCl3。
①若将AlCl3溶液蒸发至干并充分灼烧,则最终得到的固体产物为___________(填化学式)。
②AlCl3·6H2O中加入SOCl2并加热可制得无水氯化铝,其反应化学方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
II.Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O
[猜想假设] 黑色粉末X的组成可能是_________、_________,或二者的混合物。
[实验探究]
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色。 |
② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(1)实验①中产生气泡的离子方程式为_________。
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:_________。
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如下图所示实验:
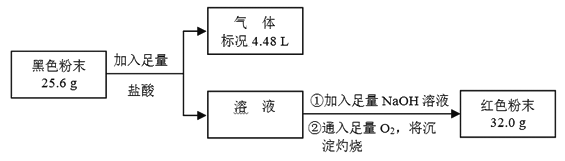
请根据数据分析说明黑色粉末X中是否含有Fe3O4。
_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是引起“温室效应”的主要物质,应该减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-a kJmol-1;
CH3OH(g)═CH3OH(l)△H=-b kJmol-1;
2H2(g)+O2(g)═2H2O(g)△H=-c kJmol-1;
H2O(g)═H2O(l)△H=-d kJmol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_______________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g)△H<0,测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
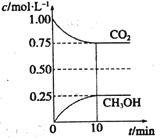
①从0min到10min,v(H2)=______。
②下列措施中能使![]() 增大的是______(选3填编号)。
增大的是______(选3填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2mol CO2和3mol H2
③计算该温度下此反应的平衡常数K=______(填分数或保留两位有效数字)。若改变______条件(填编号),可使K=1。
A.增大压强 B.增大反应物浓度 C.降低温度 D.升高温度 E.加入催化剂
(3)某甲醇燃料电池原理如图1所示
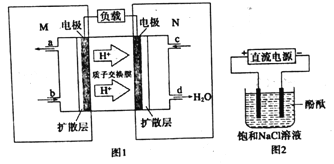
①则M区发生的电极反应式为______。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极).则该电解反应的总反应的离子方程式为:__________________。
假设溶液体积为300mL,当溶液的pH值为13时(在室温下测定),理论上消耗甲醇的质量为______(忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y的原子序数依次增大。P、n、m分别是元素W、X、Y的单质,r、q是由这些元素组成的二元化合物,r是一种淡黄色粉末,常温下0.01mol/L s溶液的pH为 12。上述物质的转化关系如图所示。下列说法正确的是
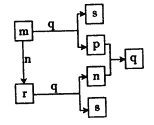
A. 离子半径:Y>X
B. 还原性:m>p
C. r、s和q中均含有离子键
D. 1 mol p与足量n反应生成气态q,放出的热量为P的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子分子中
D.含有共价键的化合物都是共价键化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com