
| A. | 第三周期第ⅤA族 | B. | 第四周期第ⅤA族 | C. | 第五周期第ⅢA族 | D. | 第四周期第ⅢA族 |
分析 纳米的材料的化学式为RN,该化合物里与氮结合的Rn+核外有28个电子,N元素为-3价,R元素为+3价,则Rn+带3个单位的正电荷,Rn+核外有28个电子,则R原子的质子数=28+3=31,书写其核外电子排布式,确定在周期表中的物质,以此解答该题.
解答 解:纳米的材料的化学式为RN,该化合物里与氮结合的Rn+核外有28个电子,N元素为-3价,R元素为+3价,则Rn+带3个单位的正电荷,Rn+核外有28个电子,则R原子的质子数=28+3=31,其元素原子核外电子排布式为1s22s22p63s23p63d104s24p1,处于第四周期第ⅢA族,
故选D.
点评 本题考查结构与物质关系,为高频考点,侧重考查原子结构与元素周期表,难度不大,注意掌握根据质子数确定元素在周期表中位置方法.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、10mL量筒 | B. | 容量瓶、100mL量筒 | ||
| C. | 100mL容量瓶、50mL量筒 | D. | 100mL容量瓶、10mL量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤炭经气化、液化和干馏等处理后,可转化为清洁能源 | |
| B. | “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒的过程中,葡萄糖发生了水解反应 | |
| C. | 地沟油和矿物油的主要化学成分相同 | |
| D. | 聚氯乙烯可以用作食品包装袋 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═A1O2-+2H2↑ | |
| B. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2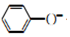 +CO2+H2O→2 +CO2+H2O→2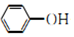 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
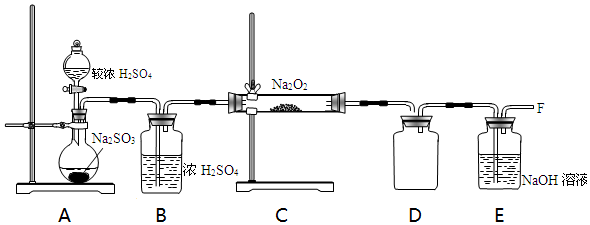
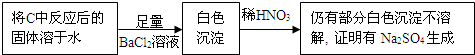
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量吸收液于试管中滴加BaCl2溶液至过量 | 白色浑浊 | 吸收液中存在SO32-和SO42- |
| 取步骤I中白色沉淀于试管中,加入过量的稀盐酸 | 固体部分溶解,产生气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 分子式 | 同分异构体数目 |
| A | CH2F2 | 2种 |
| B | C2H6O | 3种 |
| C | C3H7Cl | 4种 |
| D | C4H8 | 5种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com