
下列物质在水溶液中电离,其电离方程式错误的是( )
|
| A. | Al2(SO4)3=2Al3++3(SO4)2﹣ | B. | NaHSO4=Na++H++SO42﹣ |
|
| C. | MgCl2=Mg2++Cl2﹣ | D. | Ba(OH)2=Ba2++2OH﹣ |
考点:
电离方程式的书写.
专题:
电离平衡与溶液的pH专题.
分析:
用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等,离子团不能拆开.
解答:
解:A、硫酸铝属于盐,它的电离方程式为:Al2(SO4)3=2Al3++3SO42﹣,故A错误;
B、硫酸氢钠属于盐类,在水溶液中完全电离出三种离子,即NaHSO4=Na++H++SO42﹣,故B正确;
C、氯化镁完全电离出镁离子和氯离子,注意氯离子的写法,即MgCl2=Mg2++2Cl﹣,故C错误;
D、氢氧化钡是强碱,完全电离出钡离子和氢氧根离子,即Ba(OH)2=,Ba2++2OH﹣,故D正确.
故选AC.
点评:
掌握正确书写电离方程式的方法,并会正确判断离子方程式的正误是解题的关键所在,难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
金属铝的生产是以Al2O3为原料,在熔融状态下进行电解:2Al2O3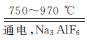 4Al+3O2↑
4Al+3O2↑
请回答下列问题:
(1)冰晶石(Na3AlF6)的作用是___________________。
(2)电解生成的金属铝是在熔融液的______________(填“上层”或“下层”)。
(3)阴极和阳极均由______________材料做成;电解时不断消耗的电极是___________(填“阳极”或“阴极”)。
(4)铝是高耗能产品,废旧铝材的回收利用十分重要。在工业上,最能体现节能减排思想的是将回收铝做成______________(填代号)。
a.冰晶石 b.氧化铝 c.铝锭 d.硫酸铝
查看答案和解析>>
科目:高中化学 来源: 题型:
将5.4 g Al投入到200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液
C.H2SO4溶液 D.HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 1mol任何气体所含分子数都相同,体积也都约为22.4 L |
|
| B. | 1molKClO3和1molSO2中,所含氧原子的个数比为3:2 |
|
| C. | 物质的量就是物质的摩尔质量 |
|
| D. | 在非标准状况下,1 mol任何物质的体积都不是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
将下列物质按酸、碱、盐、氧化物分类排列,正确的是( )
|
| A. | 硫酸、纯碱、生石灰、氧气 | B. | 醋酸、烧碱、硝酸钾、干冰 |
|
| C. | NaHSO4、乙醇、CaCO3、水 | D. | 硝酸、熟石灰、苛性钠、甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在无色透明强酸性溶液中,能大量共存的离子组是( )
|
| A. | K+、Cu2+、NO3﹣、SO42﹣ | B. | K+、Na+、Cl﹣、CO32﹣ |
|
| C. | Zn2+、NH4+、NO3﹣、Cl﹣ | D. | K+、Na+、MnO4﹣、SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
|
| A. | KClO3在反应中得到电子 |
|
| B. | H2SO4是该反应的氧化剂 |
|
| C. | H2C2O4在反应中被还原 |
|
| D. | 1 mol KClO3参加反应,有2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设阿伏伽德罗常数为NA,则下列说法正确的是( )
|
| A. | 常温下,2.7g铝与足量的氢氧化钠溶液反应失去的电子数为0.1NA |
|
| B. | 100mL1mol/LNa2SO4溶液中含Na+个数为0.1NA |
|
| C. | 1.7gNH3中含电子数为NA |
|
| D. | 11.2gCO2与8.5gNH3所含分子数都是0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com