
| 物质 | CH4 | CO2 | CO | H2 |
| 物质的量mol | 2 | 2 | 8 | 8 |

分析 (1)①根据c=$\frac{n}{V}$计算各物质的平衡浓度,代入平衡常数K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$计算;
②根据盖斯定律,已知热化学方程式乘以适当的系数进行加减构造目标热化学方程式,反应热也进行相应的计算;
(2)①由图可知,该催化剂在250℃左右时催化剂效率最高;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,注意不能只增大甲烷的浓度,否则甲烷的转化率降低;
(3)①二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2,表现为碱性氧化物的性质,与氧化性无关;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐,该盐为Li2SiO3;
(4)由图可知,二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子.
解答 解:(1)①平衡时CH4、CO2的浓度均为$\frac{2mol}{4L}$=0.5mol/L,CO、H2的浓度均为$\frac{8mol}{4L}$=2mol/L,故平衡常数K=$\frac{{c}^{2}(CO)×{c}^{2}({H}_{2})}{c(C{O}_{2})×c(C{H}_{4})}$=$\frac{{2}^{2}×{2}^{2}}{0.5×0.5}$=64,故答案为:64;
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=+2.8kJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得:CO2(g)+CH4(g)?2CO(g)+2H2(g)故△H=-890.3kJ•mol-1+2.8kJ•mol-1×2+566.0kJ•mol-1×2=+247.3 kJ•mol-1,
故答案为:+247.3 kJ•mol-1;
(2)①由图可知,该催化剂在250℃左右时催化剂效率最高,温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
②提高该反应中CH4的转化率,改变条件应使平衡向正反应方向移动,正反应是气体体积减小的反应,缩小容器体积增大压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,
故答案为:缩小体积增大压强或增大CO2的浓度;
(3)①二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2,表现为碱性氧化物的性质,与氧化性无关,IA、ⅡA族元素可以碱性氧化物,故选:ab;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3和另一种盐,根据质量守恒可知产物还有Li2SiO3,CO2和Li4SiO4反应的化学方程式为:CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3,故答案为:CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{\;}$Li2CO3+Li2SiO3;
(4)由图可知,二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子,CO2在电极a放电的反应式是:CO2+2e-═CO+O2-,故答案为:CO2+2e-═CO+O2-.
点评 本题属于拼合型题目,题目比较综合,涉及平衡常数计算、反应热计算、反应速率影响因素、化学平衡移动、原电池等,是对学生综合能力的考查,(4)中电极反应式书写,注意根据图示判断反应产物.


科目:高中化学 来源: 题型:多选题
 在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )| A. | 固体F中含有配位键 | B. | D和E分子间均可形成氢键 | ||
| C. | A、B、C三种分子均属于非极性分子 | D. | E分子中中心原子的杂化类型为sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH2CH2CH2OH | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>W>X>Y | |
| B. | 最高正价:Z>X>W>Y | |
| C. | W(XY)Z2既能与稀硫酸反应,又能与氢氧化钠溶液反应 | |
| D. | 向W、Z形成的化合物的水溶液中滴加氨水,先生产白色沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 12g金刚石中含有碳酸键的个数为2NA | |
| C. | 25℃时1.0LpH=13的NaOH溶液中含有H+的数目为0.1NA | |
| D. | 1mol的甲基与1mol的铵银离子所含电子数均为10NA. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
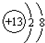 ,
, G元素的最高价氧化物电子式
G元素的最高价氧化物电子式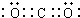
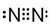 ;H的氢化物的电子式
;H的氢化物的电子式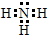
| 元素 | 实验设计 | 现象 | 结论 |
| B | 分别在两个盛有滴加酚酞的水的烧杯中加入形状相同的Na和K,观察现象 | K在反应中伴随轻微爆炸,钾比钠的反应更剧烈 | 金属性: K>Na |
| F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 含乙酸钠和对氯酚(
含乙酸钠和对氯酚(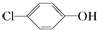 )的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )
)的废水可以利用微生物电池除去,其原理如图所示:下列有关说法不正确的是( )| A. | 电极B是负极 | |
| B. | 质子从A极移向B极 | |
| C. | B极的电极反应式:CH3COO--8e-+2H2O=2CO2+7H+ | |
| D. | 处理后的废水pH降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com