
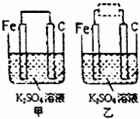
 K,Fe,C,N,O,S是中学化学常见的六种元素.
K,Fe,C,N,O,S是中学化学常见的六种元素.| 第一电离能 | 键的极性 | 熔点 | 稳定性 |
| N | H-S键 | 金刚石 | CH4 |
 ,
, .
.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
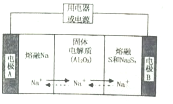 金属及其化合物在国民经济发展中起着重要作用
金属及其化合物在国民经济发展中起着重要作用| 物质 | Na | s | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:
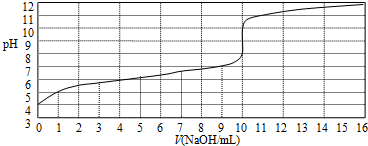
| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验可选用甲基橙作指示剂 |
| D、此实验可选用酚酞作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在铁质船体上镶嵌锌块,可以减缓船体被海水腐蚀的速率 |
| B、粗铜精炼时,电镀液中的c(Cu2+)保持不变 |
| C、纯银在空气中久置变黑发生的电化学腐蚀 |
| D、外加电流的阴极保护法是将被保护的金属与外加电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素从上到下,单质的熔点逐渐降低 |
| B、同主族元素从上到下,氢化物的熔点逐渐降低 |
| C、同周期元素(除零族元素外)从左到右,简单离子半径逐渐减小 |
| D、同周期元素(除零族元素外)从左到右,原子失电子能力逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、含Na+数目为
| ||
B、含氧原子数目为
| ||
C、完全氧化SO32-时转移电子数目为
| ||
D、含结晶水分子数目为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据物质的组成元素是否单一,将纯净物分为单质和化合物 |
| B、根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C、根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D、根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com