

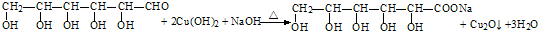
分析 Ⅰ.(1)葡萄糖还原法制Cu2O是利用葡萄糖中醛基被氢氧化铜氧化,反应生成葡萄糖酸、氧化亚铜和水,制取氢氧化铜可用可溶性铜盐和强碱反应,反应得到的葡萄糖酸与碱反应生成盐;
(2)葡萄糖与新制氢氧化铜反应需要加热,生成氧化亚铜沉淀,需要经过过滤操作进行分离;
Ⅱ.方案1:(3)氧化亚铜也和硫酸发生氧化还原反应生成硫酸铜,溶液显蓝色,同时生成Cu单质;
(4)将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是氧化亚铜样品质量和反应生成铜的质量,通过化学方程式计算分析;
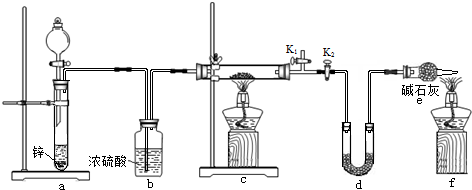
方案2:a装置产生氢气,b装置干燥氢气,c装置中氢气与铜的氧化物反应置换出Cu,d装置吸收水,可以测定生成水的质量,装置e中碱石灰的作用是防止空气中的水进入d装置,影响水质量测定;
(5)a装置产生氢气,应防止酸的挥发,应选用难挥发性的酸;
(6)点燃装置c中酒精灯之前需检验氢气的纯度;
(7)熄灭酒精灯之后,仍需通一段时间H2至试管冷却是防止空气进入氧化生成的铜,测定结果产生误差.
解答 解:Ⅰ.(1)葡萄糖还原法制Cu2O是利用葡萄糖中醛基被氢氧化铜氧化,反应生成葡萄糖酸、氧化亚铜和水,制取氢氧化铜可用可溶性铜盐和强碱反应,反应得到的葡萄糖酸与碱反应生成盐,葡萄糖还原法制Cu2O的化学方程式为: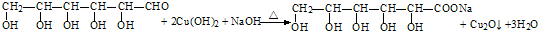 ,
,
故答案为: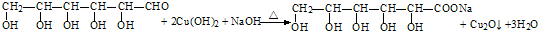 ;
;
(2)葡萄糖与新制氢氧化铜反应需要加热,故所需玻璃仪器为试管、酒精灯,分离生成的氧化亚铜沉淀,需要进行过滤操作,所需玻璃仪器为漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒;
Ⅱ.方案1:(3)氧化亚铜也和硫酸发生氧化还原反应生成硫酸铜,溶液显蓝色,同时生成Cu单质,反应的化学方程式为:Cu2O+H2SO4=CuSO4+Cu+H2O,
故答案为:Cu2O+H2SO4=CuSO4+Cu+H2O;
(4)将定性检验改为定量测定便能确定样品中是否含有CuO杂质,应测量的数据是Cu2O样品的质量、反应后剩余固体(Cu)的质量;
故答案为:Cu2O样品的质量、反应后剩余固体(Cu)的质量;
方案2:a装置产生氢气,b装置干燥氢气,c装置中氢气与铜的氧化物反应置换出Cu,d装置吸收水,可以测定生成水的质量,装置e中碱石灰的作用是防止空气中的水进入d装置,影响水质量测定,
(5)d装置中的碱石灰会吸收水和酸性气体,防止a中酸挥发,故选难挥发性酸硫酸,装置e中碱石灰的作用是防止空气中的水进入d装置,m(H2O)测定不准确;
故答案为:H2SO4;防止空气中的水进入d装置,m(H2O)测定不准确;
(6)点燃装置c中酒精灯之前需检验氢气的纯度,验纯后应保持气体能通过d装置,使生成的水全部被d装置吸收,具体操作方法为:打开K1,关闭K2,通一段时间氢气后验纯,再打开K2,关闭K1,
故答案为:打开K1,关闭K2,通一段时间氢气后验纯,再打开K2,关闭K1;
(7)灼热的铜和氧气会发生反应生成氧化铜,所以熄灭酒精灯之后,仍需通一段时间H2至试管冷却是防止空气进入氧化生成的铜,测定结果产生误差;
故答案为:防止生成的Cu单质在高温下又被氧气氧化为CuO,导致测定数据不准确.
点评 本题考查实验制备方的案设计,题目难度中等,是对学生综合能力的考查,侧重考查学生对原理、装置分析评价,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol | B. | 2 mol | C. | 7 mol | D. | 8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑥⑦⑧⑨ | B. | ②③④⑦ | C. | ③④⑤⑥⑦⑧ | D. | ③④⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有③④ | C. | 只有①③ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:O2+2H2O+4e-═4OH- | |
| B. | 负极反应为:2H2+4OH--4e-═4H2O | |
| C. | 电池工作时溶液中的阴离子移向正极 | |
| D. | 电池工作时负极区pH升高,正极区pH下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池是一种将化学能转化为电能的装置 | |
| B. | 铁船舶的外壳上镶嵌锌块,可避免船体遭受腐蚀 | |
| C. | 钢铁腐蚀时负极的电极反应式:Fe-3e-═Fe+ | |
| D. | 工业上电解饱和食盐水时阴极的电极反应式:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| D. | 在饱和的碳酸钠溶液中通入二氧化碳溶液变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属元素的化合物 | |
| B. | 明矾和漂白粉常用于自来水的净化,且原理相同 | |
| C. | 食用植物油的主要成分是高级脂肪酸甘油酯,是人体所需营养物质 | |
| D. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com