
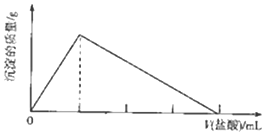
 短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )| A. | 气态氢化物的稳定性:X>R | |
| B. | 简单离子半径:X>Y>Z | |
| C. | R的最高价氧化物对应的水化物是一种强酸 | |
| D. | 用Z的单质与Y的氧化物反应可冶炼Y的单质 |
分析 短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色,该气体为氨气,则R为N元素;X原子的核外电子数与价电子数之比为4:3,原子最外层最多容纳8个电子、第一次最多容纳2个电子,则X核外电子总数为8,最外层含有6个电子,为O元素;X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂,则Y为Na元素;向YZX2的溶液中滴加盐酸,产生沉淀的质量与盐酸体积的关系如图所示,说明为NaAlO2,则Y为Na、Z为Al元素,据此进行解答.
解答 解:短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色,该气体为氨气,则R为N元素;X原子的核外电子数与价电子数之比为4:3,原子最外层最多容纳8个电子、第一次最多容纳2个电子,则X核外电子总数为8,最外层含有6个电子,为O元素;X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂,则Y为Na元素;向YZX2的溶液中滴加盐酸,产生沉淀的质量与盐酸体积的关系如图所示,说明为NaAlO2,则Y为Na、Z为Al元素,
A.非金属性越强,气态氢化物的稳定性越强,X、R分别为O、R为N元素,非金属性O>N,则气态氢化物的稳定性:X>R,故A正确;
B.离子的电子层越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则简单离子半径大小为:X>Y>Z,故B正确;
C.R为N元素,其最高价氧化物对应水合物的为硝酸,硝酸为强酸,故C正确;
D.Z的单质为Al,Y的氧化物为氧化钠,铝的还原性小于Na,无法用铝与氧化钠反应制取金属钠,故D错误;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,推断元素为解答关键,注意掌握元素周期表结构、元素周期律内容,试题培养了学生的分析能力及综合应用能力.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
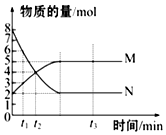 一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为VL的密闭容器里进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
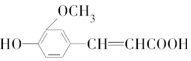 ,符合下列条件的阿魏酸的同分异构体的数目为
,符合下列条件的阿魏酸的同分异构体的数目为| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时正极上的电极反应为:Li-e-═Li+ | |
| B. | 该充电宝的凝胶介质可用KOH水溶液代替 | |
| C. | 充电时每生成14g Li,凝胶介质中有2mol电子通过 | |
| D. | 充电时电池的正极失电子后Li4V2O3会转化为V2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升降机的Al-Mg合金焊接过程中,可采用N2作保护气 | |
| B. | 为降低舰体钢材料中硅含量,冶炼过程中需使用O2和CaCO3 | |
| C. | 为测定螺旋浆Cu-Al合金中铜元素含量,只需使用氨水 | |
| D. | 为防止舰体在海水中发生电化学腐蚀,可镶嵌铜块 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结 论 |
| A | 向溶液X中滴加BaCl2溶液,有白色沉淀生成 | 溶液X中可能含有SO42- |
| B | 2mL10%的CuSO4溶液中滴加2%的NaOH溶液4~6滴制得新制氢氧化铜,再滴加几滴葡萄糖溶液,加热 | 检验葡萄糖中含有醛基 |
| C | 向1mL浓度均为0.05mol•L-l NaCl、NaI的混合溶液中滴加2滴0.01mol•L-lAgNO3溶液,振荡,沉淀呈黄色 | Ksp (AgCl)<Ksp(AgI) |
| D | 将Al2(SO4)3溶液蒸干、灼烧至恒重 | 最终剩余固体是Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
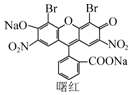
| A. | 不能与盐酸发生反应 | |
| B. | 分子中含1个手性碳原子 | |
| C. | 能发生取代、加成、消去反应 | |
| D. | 1 mol曙红最多能与4 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
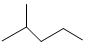 表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.
表示的分子式C6H14;系统命名法的名称是2-甲基戊烷.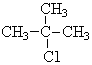 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com