
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。
【答案】 > 不变 向正反应方向 1×10-12 1:10
【解析】试题分析:本题考查外界条件对化学平衡的影响,水的离子积的计算,酸碱混合溶液pH的计算。
(1)① 反应C(s)+H2O(g)![]() CO(g)+ H2(g)的特点是:正反应是气体分子数增大的反应。建立平衡过程中气体分子物质的量增大,平衡时气体分子物质的量大于起始物质的量;A为恒温恒容容器,建立平衡过程中A中气体压强增大,平衡时压强大于起始时压强;B为恒温恒压容器,建立平衡过程中B的体积增大,平衡时体积大于起始时体积;平衡时A中压强大于B中压强,B相当于在A达到平衡后减小压强,减小压强平衡向正反应方向移动,H2O的体积分数减小,V(A)%
CO(g)+ H2(g)的特点是:正反应是气体分子数增大的反应。建立平衡过程中气体分子物质的量增大,平衡时气体分子物质的量大于起始物质的量;A为恒温恒容容器,建立平衡过程中A中气体压强增大,平衡时压强大于起始时压强;B为恒温恒压容器,建立平衡过程中B的体积增大,平衡时体积大于起始时体积;平衡时A中压强大于B中压强,B相当于在A达到平衡后减小压强,减小压强平衡向正反应方向移动,H2O的体积分数减小,V(A)%![]() V(B)%。
V(B)%。
②A为恒温恒容容器,通入氦气,各物质的浓度不变,化学平衡不移动,A中H2O的转化率不变。B为恒温恒压容器,通入氦气,体积增大,相当于减小压强,平衡向正反应方向移动。
(2)0.01mol/LNaOH溶液中c(OH-)=0.01mol/L,pH=10即c(H+)=1![]() 10-10mol/L,该温度下KW=c(H+)·c(OH-)=1
10-10mol/L,该温度下KW=c(H+)·c(OH-)=1![]() 10-10mol/L
10-10mol/L![]() 0.01mol/L=1
0.01mol/L=1![]() 10-12mol2·L-2。因为NaOH溶液与H2SO4溶液混合后溶液为中性,则NaOH溶液中的OH-物质的量等于H2SO4溶液中H+物质的量,
10-12mol2·L-2。因为NaOH溶液与H2SO4溶液混合后溶液为中性,则NaOH溶液中的OH-物质的量等于H2SO4溶液中H+物质的量, ![]() mol/L
mol/L![]() aL=1
aL=1![]() 10-2mol/L
10-2mol/L![]() bL,则a:b=1:10。
bL,则a:b=1:10。


科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为_____________。
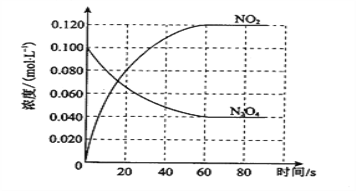
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,该溶液呈酸性,其原因用离子方程式解释是:____________。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有(____)
a.CaCl2溶液 b.氨水 c.Ca(OH)2悬浊液 d.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 __________ 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g);△H<0。该反应平衡常数表达式K= ________;温度升高K值______(填“增大”或“减小” )
2CO2(g) + N2(g);△H<0。该反应平衡常数表达式K= ________;温度升高K值______(填“增大”或“减小” )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L氯化氢气体溶于635 mL的水(密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。求:
(1)该盐酸的溶质质量分数是多少?______________
(2)取这种盐酸10.0 mL,稀释到1.00 L,所得的稀盐酸的物质的量浓度多少?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维尔纳配合物M是一种橙黄色单斜晶体,该晶体以浓氨水、双氧水、CoCl2·6H2O、NH4Cl为原料在加热条件下通过活性炭的催化来合成。为探究该晶体的组成,设计了如下实验:
步骤一,氮的测定:准确称取一定量橙黄色晶体,加入适量水溶解,注入下图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品中的氨全部蒸出,用500.00mL7.0mol/L的盐酸溶液吸收,吸收结束后量取吸收液25.00mL,用2.00mol/L的NaOH溶液滴定过量的盐酸,终点消耗NaOH溶液12.50mL。
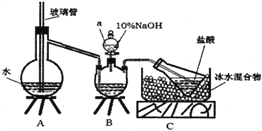
步骤二,氯的测定:准确称取橙黄色晶体wg,配成溶液后用AgNO3标准溶液滴定,以K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色沉淀)。
(1)上述装置A中,玻璃管的作用是________;装置B中仪器a的名称为_________。
(2)装置A、B三脚架处应放置一个酒精灯作为热源,酒精灯应放置在____(填“A”或“B”)处。
(3)步骤一所称取的样品中含氮的质量为_________g。
(4)有同学提出装置C中所用盐酸的浓度过大易挥发,会造成测得氮的含量结果将_______(填“偏高”、“偏低”或“无影响”);冰水混合物的作用是___________。
(5)测定氯的过程中,使用棕色滴定管的原因是_________;出现浅红色沉淀时,若溶液中c(CrO42-)=0.0025mol/L,通过计算说明该实验可以使用K2CrO4溶液为指示剂的原因______(呈现计算过程)。已知:Ksp(Ag2CrO4)=1.0×10-12Ksp(AgCl)=1.8×10-10
(6)经上述实验测定,配合物M中钴、氮、氯的物质的量之比为1:6:3,其中氮元素以氨的形式存在。制备M的化学方程式为_____________________,其中双氧水的作用是__________;制备M的过程中温度不能过高的原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是马路上的第一大杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生如下反应:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应________(填“是”或“不是”)离子反应。
(2)写出Cr2(SO4)3的电离方程式:______________________________________。
(3)该反应________(填“是”或“不是”)氧化还原反应,判断的依据是_________________________________。
(4)你认为能否用这一反应来检测司机是否酒后驾车?________(填“能”或“不能” ),简述其原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个体积相同的容器,一个盛有NO,另外一个盛有N2和O2,在标准状况下两容器内的气体一定具有相同的( )
①原子总数;②质子总数;③分子总数;④质量
A.①②B.②④C.②③D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置中,U型管内为红墨水,a,b试管内分别盛有食盐水和氯化铁溶液。各加入生铁块放置一段时间。下列有关描述错误的是( )
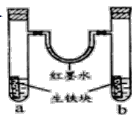
A. 生铁比纯铁更易被腐蚀
B. 红墨水柱两边的液面变为左高右低
C. 两试管中相同的电极反应式是:Fe-2e-→Fe2+
D. a试管中发生了吸氧腐蚀,正极反应式为O2+4e-+4H+=2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com