
| 二氧化锰与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
| 1 |
| 10 |
| 1 |
| 10 |
| 二氧化锰 |
| 加热 |
| 二氧化锰 |
| 加热 |


科目:高中化学 来源: 题型:
| A、制普通玻璃的主要原料是烧碱、石灰石、石英 |
| B、晶体硅可用于制作半导体材料 |
| C、实验室用带玻璃塞的试剂瓶保存氢氧化钠溶液 |
| D、光导纤维的主要成份是硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
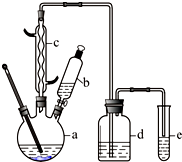 溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下:
溴苯是一种化工原料,某兴趣小组用如下装置制备溴苯并证明苯和液溴发生的是取代反应,而不是加成反应.有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
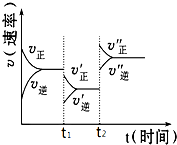 如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )
如图是可逆反应A(g)+2B(g)?2C(g)+3D(g),(正反应△H>0)的化学反应速率与化学平衡随外界条件改变而变化的关系图,下列条件的改变与图中情况相符的是( )| A、t1时,减小了A或B的物质的量的浓度 |
| B、t2时,升高了温度 |
| C、t2时,增大了压强 |
| D、t1时,加了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑥ | B、②③⑤ |
| C、①②③⑥ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用恰当的还原剂,可以在较低的温度下把金属从矿石中提取出来 |
| B、研制出性能优良的催化剂可以使反应温度降低,提高反应速率,从而起到节能效果 |
| C、制水泥、玻璃等硅酸盐工业需要消耗大量能源,我们应通过降低其产量来节能 |
| D、利用铝的还原性和铝转化为氧化铝时能放出大量热的性质,工业上常用铝粉来还原一些金属氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com