
【题目】(1)1L 0.05mol/LNaHCO3溶液与足量的盐酸完全反应,放出10kJ的热量,写出此反应的热化学方程式________________________________________________________
(2)写出明矾溶液与碳酸氢钠溶液反应的离子方程式______________
(3)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象_________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象_________
(4)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105mol·L1)时,溶液中c(Ag+)为_______mol·L1,此时溶液中c(CrO42)等于__________mol·L1。(已知Ag2 CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
【答案】 NaHCO3(aq)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) △H= -200kJ/mol Al3++3HCO3-=Al(OH)3↓+3CO2↑ 当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变 2×10-5 5 ×10-3
【解析】试题分析:本题考查热化学方程式的书写,双水解反应离子方程式的书写,外界条件对化学平衡的影响,溶度积的计算。
(1)n(NaHCO3)=0.05mol/L![]() 1L=0.05mol,1molNaHCO3参加反应放出的热量为
1L=0.05mol,1molNaHCO3参加反应放出的热量为![]() =200kJ,反应的热化学方程式为NaHCO3(aq)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) △H= -200kJ/mol。
=200kJ,反应的热化学方程式为NaHCO3(aq)+HCl(aq)=NaCl(aq)+CO2(g)+H2O(l) △H= -200kJ/mol。
(2)明矾溶液和碳酸氢钠溶液发生双水解反应,反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑。
(3)当少量酸性物质进入血液中,H+浓度增大,平衡向右移动,使H+浓度变化较小,血液的pH基本不变;当少量碱性物质进入血液中,OH-与H+反应,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。
(4)当溶液中Cl-恰好沉淀完全时,Ksp(AgCl)=c(Ag+)·c(Cl-)=2.0![]() 10-10,c(Ag+)=2.0
10-10,c(Ag+)=2.0![]() 10-10
10-10![]() (1.0×105)=2.0
(1.0×105)=2.0![]() 10-5(mol/L)。Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=2.0×1012,c(CrO42-)=2.0×1012
10-5(mol/L)。Ksp(Ag2CrO4)=c2(Ag+)·c(CrO42-)=2.0×1012,c(CrO42-)=2.0×1012![]() (2.0
(2.0![]() 10-5)2=5
10-5)2=5![]() 10-3(mol/L)。
10-3(mol/L)。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的还原性依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是( )

A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,![]() 随温度升高而减小
随温度升高而减小
D. a→c过程中水的电离程度始终增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用或实验操作正确的是( )
A. 蒸发NaCl溶液获取NaCl晶体,要将溶液中的水分蒸干
B. 使用容量瓶配制一定物质的量浓度溶液时,要先检验容量瓶是否漏水
C. 用托盘天平称量6.25克Na2CO3
D. 可以使用酒精萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ K=1.75×10-5。
CH3COO-+H+ K=1.75×10-5。
(1)计算0.01mol/L的CH3COOH溶液的pH=_________。(已知lg1.75=0.24)
(2)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___________mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=______________mol/L。
(3)下列方法中,可以使0.10 mol·L-1 CH3COOH的电离程度增大的是___________
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1 d.加入少量冰醋酸
e.加入少量镁粉 f.加入少量0.10 mol·L-1的NaOH溶液
(4)SOCl2是一种液态化合物,向盛有10mL水的锥形瓶中,小心滴加8~10滴SOCl2,可观察到剧烈反应,液面上有雾形成,产生可以使品红溶液褪色的气体,往溶液中滴加AgNO3溶液,有白色沉淀析出,请写出SOCl2与水反应的化学方程式______________________________,蒸干AlCl3溶液不能得到无水AlCl3,用SOCl2和AlCl3·6H2O混合加热可以得到无水AlCl3,试解释原因______________________
(5)常温下,反应NH4++HCO3-+H2O ![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下,NH3·H2O的电离平衡常数Kb = 2×10-5,H2CO3的电离平衡常数Ka1 = 4×10-7,Ka2 = 4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验中,不考虑两球的浮力变化)( ) 
A.杠杆为导体或绝缘体时,均为A端高B端低
B.杠杆为导体或绝缘体时,均为A端低B端高
C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低
D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X,Y,Z,R,T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族.五种元素原子半径与原子序数之间的关系如图所示.下列推断正确的是( ) 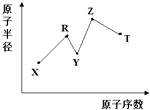
A.离子半径:Y<Z
B.氢化物的沸点:Y<T
C.最高价氧化物对应水化物的酸性:T<R
D.由X,Y,Z,R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.甲醇、乙二醇、丙三醇都易溶于水且都有毒
B.含有羟基的化合物属于醇类
C.乙酸呈弱酸性,能使石蕊试液显浅红色
D.酚类和醇类具有相同的官能团, 因而具有相同的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关A、B、C、D四种固体样品的性质中,最可能是有机物的是( )
性质 | 熔点 | 水溶性 | 稳定性(高温、加热) | 导电性 |
A | 高 | 溶 | 稳定 | 导电 |
B | 低 | 不溶 | 分解 | 不导电 |
C | 高 | 不溶 | 稳定 | 不导电 |
D | 低 | 溶 | 分解 | 导电 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com