
在元素周期表中
1.周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。
ⅡA族后面是第_______族。所含元素的种类最多的是____________族;
2. 同一周期,从左向右,原子半径逐渐_____________,金属性逐渐__________;
3.同一主族,从上到下,原子半径逐渐_____________,还原性逐渐__________;
4. 同一元素的阴离子半径________相应的原子半径,电子层结构相同的离子,
核电荷数越多,半径越__________。
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
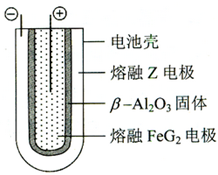 (2012?天津)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
(2012?天津)X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.

| 充电 | 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.160 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | |||
| 其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 六种元素中原子半径最大 | 次外层电子数是最外层电子数的4倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在元素周期表中
1.周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。
ⅡA族后面是第_______族。所含元素的种类最多的是____________族;
2. 同一周期,从左向右,原子半径逐渐_____________,金属性逐渐__________;
3.同一主族,从上到下,原子半径逐渐_____________,还原性逐渐__________;
4. 同一元素的阴离子半径________相应的原子半径,电子层结构相同的离子,
核电荷数越多,半径越__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com