
| A. | 电子层数 | B. | 原子核内质子数 | C. | 原子半径 | D. | 最外层电子数 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:选择题
| A. | 7 | B. | 6 | C. | 5 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氟酸应保存在塑料盖的玻璃瓶中 | |
| B. | 浓盐酸一定要存放在棕色瓶中,可防止挥发 | |
| C. | 液溴应盛放在橡胶塞的棕色瓶中 | |
| D. | 固态碘应放在广口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O(g)→H2O(1)+44.0kJ | B. | 2HI(g)→H2(g)+I2(g)-9.4kJ | ||
| C. | 浓硫酸溶于水 | D. | 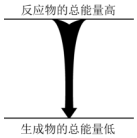 能量变化如图所示的化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 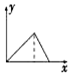 | B. | 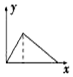 | C. | 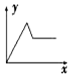 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量:mol/g | B. | 物质量:mol | ||
| C. | 溶解度:g/100g | D. | 气体摩尔体积:L/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LL任何气体都约含NA个气体分子 | |
| B. | 标准状况下,1mol液溴的体积约为22.4L | |
| C. | 1mol铁与足量盐酸反应,转移电子数为3NA | |
| D. | 18gNH4+中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
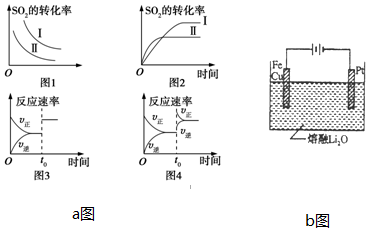
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com