
将一定量的铁粉和硫粉的混合物共热,充分反应后冷却再加入足量稀硫酸,得到标准状况下的气体11.2 L,则原混合物可能的组成是n代表物质的量
A.n(Fe)<n(S)总质量等于44 g
B.n(Fe)> n(S)总质量等于44 g
n(S)总质量等于44 g
C.n(Fe)=n(S)总质量大于44 g
D.n(Fe)>n(S)总质量小于44 g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4===Na2SO4+SO2↑+S↓+
H2O,下列各组实验中最先出现浑浊的是 ( )
| 实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | ||
| A | 25 | 5 | 0.1 | 10 | 0. | 5 |
| B | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| C | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| D | 35 | 5 | 0.2 | 5 | 0.2 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从经济利益和环境保护考虑,大量制取硝酸铜最宜采用的方法是( )
A.Cu+AgNO3Cu(NO3)2
B.Cu+HNO3(稀)Cu(NO3)2
C.Cu+HNO3(浓)Cu(NO3)2
D.Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2溶于水后所得的溶液具有的性质是( )
A.有氧化性、无还原性、无酸性 B.有氧化性、有还原性、有酸性
C.有还原性、无氧化性、无酸性 D.有还原性、无氧化性、有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
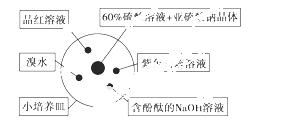
A.紫色石蕊溶液变蓝色 B.品红溶液褪色
C.溴水橙色褪去 D.含酚酞的NaOH溶液红色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正
确的是
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是 ( )
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有S |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 向浓度均为0.1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸。
(1)氨气催化氧化的化学方程式为 ▲_
 (2)某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发
(2)某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发 生的反应为: 6NOx+4xNH3=(3+2x)N2+6xH2O 若处理1×
生的反应为: 6NOx+4xNH3=(3+2x)N2+6xH2O 若处理1× L(标准状况)该尾气需42.5gNH3,则x= ▲_ 。
L(标准状况)该尾气需42.5gNH3,则x= ▲_ 。
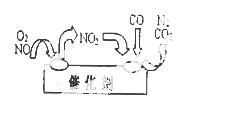
(3)NO和CO都是汽车尾气中的有害物质,必须进行处理。为避免污染, 常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出净化过程中的总化学反应方程式: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.HOOC—CH2一CH (OH)一COOH与苹果酸 互为同分异构体
互为同分异构体
B.乙醇和甘油互为同系物,它们在铜丝催化氧化后的产物也是同系物
C.糖类、油脂、蛋白质的水解产物都是非电解质
D.浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用此物保鲜水果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com