
原子序数依次增大的X、Y、Z、R、W、T六种前20号元素,X、Y原子的最外层电子数与其电子层数相等,Y、T位于同族,R最外层电子数是次外层的3倍,W无正价,甲的化学式为ZX3,是一种刺激性气味的气体,乙是由X、Z、W组成的盐。下列说法正确的是
A.由X、Z、W组成盐的水溶液呈酸性,则溶液中该盐阳离子浓度小于酸根离子浓度
B.气态氢化物的稳定性:W<R< Z
C.原子半径:W <Z<Y,而简单离子半径:Y<Z<W
D.ZR2、TR2两化合物中R的化合价相同
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
已知:
2Zns)+O2g)===2ZnOs) ΔH=-701.0 kJ·mol-1
2Hgl)+O2g)===2HgOs) ΔH=-181.6 kJ·mol-1
则反应Zns)+HgOs)===ZnOs)+Hgl)的ΔH为 )。
A.+519.4 kJ·mol-1 B.+259.7 kJ·mol-1
C.-259.7 kJ·mol-1 D.-519.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
按右图所示的装置进行电解实验,A极是铜锌合金,B极为纯铜,电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极的质量增加7.68 g,溶液的质量增加0.03 g,则铜锌合金中Cu、Zn原子的个数比为
( )。

A.3∶1 B.4∶1 C.2∶1 D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活、生产和社会可持续发展密切相关,下列说法正确的是
A.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
B.采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,可提高空气质量
C.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
D.DNOP(邻苯二甲酸二辛酯)是一种由邻苯二甲酸和正辛醇经酯化反应而得的一种酯类有机化合物,常用作增塑剂、溶剂以及气相色谱固定液,对人体无害,可用作食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为 。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是 (用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤; d. 烘干,研磨。
查看答案和解析>>
科目:高中化学 来源: 题型:
某密闭容器中存在2NO+O2 2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
2NO2反应,平衡时NO的转化率与温度变化关系如图所示(曲线上任何一点都表示平衡状态),下列说法中正确的是( )
A.该反应的正反应是吸热反应。
 B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
B.若温度为T1、T3时的平衡常数分别为K1、K3, 则K1<K3。
C.T1时,当反应处于D点,则该反应的逆反应速率
大于正反应速率。
D.如果缩小容器体积,则平衡时表示NO转化率与温度变化关系的
曲线在原曲线上方。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、101 kPa下,ΔH=-113 kJ·mol-1、ΔS=-145 J·mol-1·K-1。下列说法中错误的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.该反应常温下不能自发进行,因此需要高温和催化剂
C.该反应常温下能自发进行,高温和催化剂只是加快反应的速率
D.汽车尾气中的这两种气体会与血红蛋白结合而使人中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
能够充分说明在恒温恒容下的密闭容器中,反应2SO2(g)+O2(g) 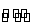
2SO3(g)已达平衡状态的标志是( )
A.容器中SO2、O2、SO3的物质的量之比为2∶1∶2
B.SO2和SO3的物质的量浓度相等
C.反应容器内压强不随时间变化而变化
D.单位时间内生成2 mol SO3的同时生成1 mol O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com