
下列推断正确的是( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5.装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2═Na2S2O5
(1)装置Ⅰ中产生气体的化学方程式为 .
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 .
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹时仪器已略去)为 (填序号)

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)证明NaHSO3溶液中HSO3﹣的电离程度大于水解程度,可采用的实验方法是 .
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是 .
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O═H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g•L﹣1.
②在上述实验过程中,若有部分HI被空气氧化,则测定结果 (填“偏高”“偏低”或“不变”).

查看答案和解析>>
科目:高中化学 来源: 题型:
关于中和热测定实验的下列说法不正确的是( )
A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B.使用环形玻璃棒既可以搅拌又避免损坏温度计
C.向盛装酸的烧杯中加碱时要小心缓慢
D.测定酸后的温度计要用蒸馏水清洗干燥后再测碱的温度

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
(1)化学在环境保护中趁着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO3—的原理如图所示。
|
 ①直流电源A为 极,阳极反应式为 。
①直流电源A为 极,阳极反应式为 。 ②若电解过程中转移了2mol电子,则电源B端连接的电极产生的标况下的气体体积为 L。




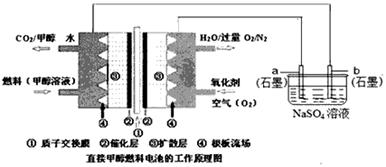
|
②碱性条件下,通入甲醇的一极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式中,正确的是( )
A.二氧化氮与水反应:3NO2+H2O===NO+2H++2NO3-
B.二氧化硫与氢氧化钠溶液反应:SO2+OH-===SO32-+H2O
C.硫酸与氢氧化钡溶液反应:H++OH-===H2O
D.氧化铝与氢氧化钠溶液反应:Al2O3+2OH-===2AlO2-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子,得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、e、d、c B.e、b、a、d、c
C.c、d、e、a、b D.b、a、d、c、e
查看答案和解析>>
科目:高中化学 来源: 题型:
某烷烃相对分子质量为86,如果分子中含有3个—CH3、
2个—CH2—和1个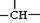 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立
体异构)
A.4 B.5 C.6 D.9
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物Ⅴ是中药黄芩中的主要活性成分之一,具有抗氧化和抗肿瘤作用。化合物Ⅴ也可通过下图所示方法合成:
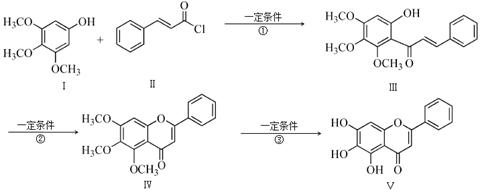
回答下列问题:
(1)化合物Ⅲ的分子式为 ,1 mol该物质完全燃烧需消耗 mol O2.
(2)化合物Ⅱ的合成方法为:
|
 -CHO+(CH3CO)2O →
-CHO+(CH3CO)2O →
 -CH=CHCOOH+ A
-CH=CHCOOH+ A
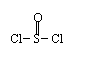 |
|


 -CH=CHCOOH 化合物Ⅱ
-CH=CHCOOH 化合物Ⅱ 已知在合成肉桂酸的化学反应中,反应物的物质的量之比为1︰1,生成物A可与饱和NaHCO3溶液反应产生气体,则生成物A的结构简式是 。
(3)反应①的反应类型为 。化合物Ⅰ和Ⅱ反应还可以得到一种酯,生成该酯的反应方程式为 。(不用注明反应条件)
(4)下列关于化合物Ⅳ、Ⅴ的说法正确的是 (填序号)。
a.都属于芳香化合物
b.都能与H2发生加成反应,Ⅳ消耗的H2更多
c.都能使酸性KMnO4溶液褪色
d.都能与FeCl3溶液发生显色反应
(5)满足以下条件的化合物Ⅰ的同分异构体Ⅵ的结构简式为
①遇FeCl3溶液显示紫色
②l mol Ⅵ与浓溴水反应,最多消耗1 mol Br2
③Ⅵ的核磁共振氢谱有五组峰,峰面积之比为1︰1︰2︰2︰6
查看答案和解析>>
科目:高中化学 来源: 题型:
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mo l·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
l·L-1 HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是
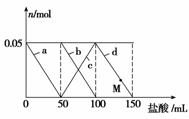
A.a曲线表示的离子方程式为:AlO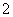 +H++H2O===Al(OH)3↓
+H++H2O===Al(OH)3↓
B.b和c曲线表示的离子反应是相同的
C.M点时,溶液中沉淀的质量为3.9 g
D.原混合溶液中的CO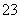 与AlO
与AlO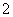 的物质的量之比为1∶2
的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com