
| A. | 氢处于第一周期 | B. | 第三周期元素全部是金属元素 | ||
| C. | 第二周期共有8种元素 | D. | 氯处于VⅡA族 |
分析 A、H原子的质子数为1,原子结构中只有一个电子层;
B、第三周期元素有Na、Mg、P、S、Cl等元素;
C、第二周期元素的质子数分别为3、4、5、6、7、8、9、10;
D、Cl原子的质子数为17,原子结构中最外层电子数为7.
解答 解:A、因H原子的质子数为1,原子结构中只有一个电子层,则位于元素周期表中的第一周期,故A正确;
B、第三周期元素有Na、Mg、P、S、Cl等元素,Na、Mg等属于金属元素,P、S、Cl等属于非金属元素,故B错误;
C、第二周期元素的质子数分别为3、4、5、6、7、8、9、10,共8种元素,故C正确;
D、因Cl原子的质子数为17,原子结构中最外层电子数为7,则处于VⅡA族,故D正确;
故选B.
点评 本题考查原子的结构和元素在元素周期表中的位置,明确短周期中的元素及元素的质子数、元素的分类是解答本题的关键.


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:解答题

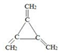 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46 | B. | 40 | C. | 37.5 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能发电技术是将化学能转化为电能 | |
| B. | 集热技术是将太阳能转化为热能 | |
| C. | 光-热转化是目前技术最成熟、成本最低廉、应用最广泛的利用太阳能形式 | |
| D. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

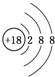 .元素K名称为氯在周期表中的位置第三周期第ⅦA族.
.元素K名称为氯在周期表中的位置第三周期第ⅦA族.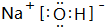
 HClO+HCl.
HClO+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
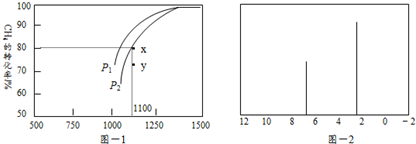
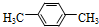 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | 实验目的 | T/K | Fe/g | c(H2SO4)/mol•L-1 |
| ① | 为以下实验作参考 | 298 | 10 | 1.0 |
| ② | 探究温度对反应速率的影响 | |||
| ③ | 298 | 10 | 18.4 |
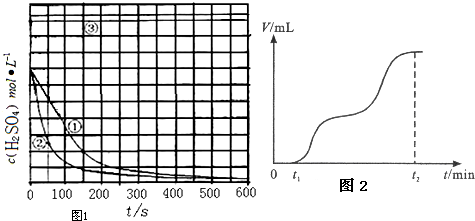
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com