
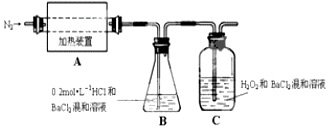
分析 (1)氮元素和铁元素化合价升高,根据在氧化还原反应中化合价有升必有降,化合价降低的应该是硫,所以气体产物中还可能有SO2;
(2)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在BC装置中完全吸收;
②为验证A中残留物是否含有FeO,应该先用稀硫酸溶解,然后再用KMnO4溶液检验亚铁离子;
③装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则b小于a;
⑤C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+一.
解答 解:(1)氮元素和铁元素化合价升高,根据在氧化还原反应中化合价有升必有降,化合价降低的应该是硫,所以气体产物中还可能有SO2;
故答案为:SO2;
(2)①A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在BC装置中完全吸收;
故答案为:使分解产生的气体在B、C中被吸收充分;
②为验证A中残留物是否含有FeO,应该先用稀硫酸溶解,然后再用KMnO4溶液检验亚铁离子,故选BD,
故答案为:BD;
③装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊;
故答案为:SO3;溶液变浑浊;
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,根据化合价升降必相等,硫降低的化合价(2a)等于铁升高的化合价(2b)和氮升高的化合价之和,则b小于a,
故答案为:小于;
⑤C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+,
故答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+.
点评 本题考查了物质性质的实验探究和实验设计,注意氧化还原反应和盐类水解等知识的灵活应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 天然气和沼气的主要成分是甲烷 | |
| B. | 乙醛含有碳氧双键,能发生加成反应 | |
| C. | 只有碳、氢两种元素组成的有机化合物称为烃 | |
| D. | 苯可以发生加成反应,因为苯中含有碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地沟油经过处理,可用来制造肥皂 | |
| B. | 向食品中添加抗氧化剂(维C)可以对食物起到防腐作用 | |
| C. | 我国的汽油标准已由“国Ⅲ”提高到国“Ⅳ”,这意味着汽车不再排放氮氧化合物 | |
| D. | CO2和CH4都是产生温室效应的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
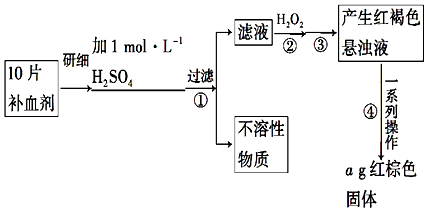
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
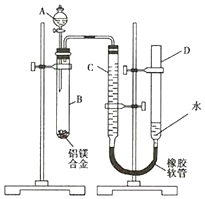 某学习小组用如图装置测定镁铝合金中铝的质量分数.
某学习小组用如图装置测定镁铝合金中铝的质量分数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管可以用来装所有的酸或酸性溶液 | |
| B. | 灼烧Na2CO3•10H2O 晶体时应选用耐高温的石英坩埚 | |
| C. | 实验室制取乙酸乙酯时用饱和NaHCO3溶液收集产物 | |
| D. | 测定溶液的pH时,在玻璃板上放一片干燥的pH试纸,用玻璃棒蘸取取待试液滴到pH试纸上,把试纸与标准比色卡比较,读出溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铜与稀硫酸反应:OH-+H+═H2O | |
| B. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com