
| A. | 1:1 | B. | 5:3 | C. | 3:2 | D. | 7:4 |
分析 设合金的质量为2mg,根据n=$\frac{m}{M}$分别计算出Mg、Al的物质的量,Mg不与氢氧化钠溶液反应,根据2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,Al与足量酸或碱溶液反应生成氢气的量相同,然后利用电子守恒计算出生成氢气的物质的量,再根据相同条件下气体体积之比等于物质的量之比计算.
解答 解:根据2Al+6HCl=2AlCl3+3H2↑、2Al+2H2O+2NaOH=2NaAlO2+3H2↑可知,Al与足量酸或碱溶液反应生成氢气的量相同,Mg不与氢氧化钠溶液反应,
设合金的质量为2mg,Mg、Al的质量都是mg,mg Mg的物质的量为:$\frac{mg}{24g/mol}$=$\frac{m}{24}$mol,mgAl的物质的量为:$\frac{mg}{27g/mol}$=$\frac{m}{27}$mol,
根据电子守恒可知,该合金与盐酸反应生成氢气的物质的量为:$\frac{\frac{m}{24}mol×2}{2}$+$\frac{\frac{m}{27}mol×3}{2}$=$\frac{m}{24}$mol+$\frac{m}{18}$mol,
该合金与氢氧化钠溶液反应时,只有Al参与反应,根据电子守恒生成氢气的物质的量为:$\frac{\frac{m}{27}mol×3}{2}$=$\frac{m}{18}$mol,
相同条件下气体体积之比等于其物质的量之比,则放出氢气在同温同压下的体积比=($\frac{m}{24}$mol+$\frac{m}{18}$mol):$\frac{m}{18}$mol=7:4,
故选D.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
 某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:
某研究人员应用如图所表示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液产生白色沉淀,一定含有SO42- | |
| B. | 取溶液进行焰色反应是黄色,一定含有Na+ | |
| C. | 加入碳酸钠溶液产生白色沉淀,一定含有Ca2+ | |
| D. | 加入稀盐酸产生无色气体,一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Si→SiO2→H2SiO4→Na2SiO3 | B. | Fe→FeCl2→FeCl3→Fe(OH)3 | ||
| C. | Na→Na2CO2→Na2O2→NaOH | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是中学常见的强酸,D的浓溶液与铜共热可生成A:F的浓度液与X共热通常用于中学实验室制备单质C:B和X混合是实验室常温下简易制单质E的一种方法,X是一种黑色粉末,B的分子中有18个电子.反应中部分生成物略去,试回答下列问题:
已知A-F是中学化学中常见的物质,其中A、C、E、F为气体,B、D为液体,D是中学常见的强酸,D的浓溶液与铜共热可生成A:F的浓度液与X共热通常用于中学实验室制备单质C:B和X混合是实验室常温下简易制单质E的一种方法,X是一种黑色粉末,B的分子中有18个电子.反应中部分生成物略去,试回答下列问题: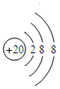 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 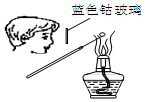 检验Na2CO3 中的Na+ | B. | 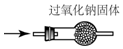 除去CO中混有的CO2 | ||
| C. | 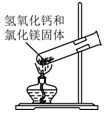 制取氨气 | D. | 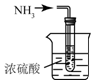 吸收氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
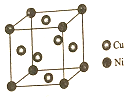 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com