
【题目】常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42-、HCO3-
C.c(Fe3+)=0.1 mol·L-1的溶液:H+、Al3+、Cl-、SCN-
D.![]() =0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3-
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。

据此判断下列说法中正确的是( )
A.石墨转变为金刚石是吸热反应
B.S(g)+O2(g)![]() SO2(g) ΔH1,S(s)+O2(g)
SO2(g) ΔH1,S(s)+O2(g)![]() SO2(g) ΔH2,则ΔH1>ΔH2
SO2(g) ΔH2,则ΔH1>ΔH2
C.白磷比红磷稳定
D.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH>0
CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况图所示,回答下列问题。
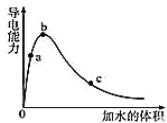
(1)a、b、c三点醋酸电离程度由大到小的顺序为________;a、b、c三点对应的溶液中c(H+)最大的是________。
(2)若实验测得c点处溶液中c(CH3COOH)=0.01 mol·L-1,c(CH3COO-)=0.0001 mol·L-1,则该条件下CH3COOH的电离常数Ka=________________。
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是(_______)。
A.c(H+) B.溶液pH C.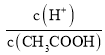 D.CH3COOH分子数
D.CH3COOH分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是 ( )
A.明矾溶液中加入过量的氨水 Al3++4OH-=AlO2-+2H2O
B.次氯酸钙溶液中通入过量二氧化碳:ClO-+H2O+CO2=HClO+CO32-
C.用石墨作电极电解饱和食盐水: ![]()
D.澄清的石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-=CaCO3↓+ 2H2O + CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化 如图所示。下列叙述中正确的是 ( )
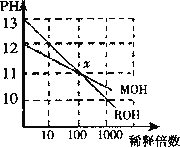
A.ROH是一种强碱
B.在x点,MOH完全电离
C.在x点,c(M+)>c(R+)
D.稀释前,c(ROH)=10c(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应的化学方程式中,属于水解反应的是( )
A.H2O+ H2O![]() H3O++OH-
H3O++OH-
B.CO2+H2O![]() H2CO3
H2CO3
C.HCO3-+OH-![]() H2O+CO32-
H2O+CO32-
D.CO32-+ H2O![]() HCO3- +OH-
HCO3- +OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应: PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
PCl5(g)达平衡时,PCl5为0.40mol,如果此时再移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40molB.0.20mol
C.小于0.20molD.大于0.20mol,小于0.40mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为_________。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
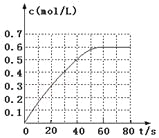
① 298k时,该反应的平衡常数为_____L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是______:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)___V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
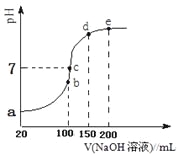
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序___________。
③d、e点对应溶液中,水电离程度大小关系是d______e(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com