
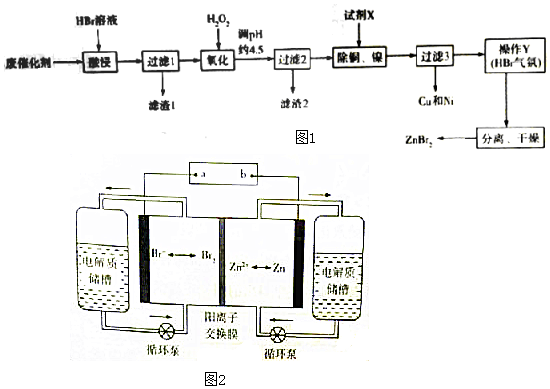
分析 用含锌废催化剂(主要含ZnO,杂质有FeO、CuO、NiO及SiO2)加入 HBr溶液酸浸过滤,杂质中ZnO、FeO、CuO、NiO溶解,二氧化硅不溶,过滤得到滤渣1为SiO2,滤液中加入过氧化氢氧化亚铁离子生成铁离子,调节溶液PH4.5沉淀铁离子,过滤得到滤渣2为Fe(OH)3,滤液中加入过量锌除去铜和镍,过滤3得到铜和镍金属和过量锌,滤液为溴化锌溶液,蒸发浓缩、冷却结晶、过滤洗涤、干燥得到溴化锌晶体,
(1)提高浸取速率可以提高温度、加快搅拌、粉碎固体、增大浓度等措施;过滤1得到滤渣是二氧化硅;
(2)滤渣2为沉淀氢氧化铁;
(3)加入过量锌粉和铜离子、镍离子反应除去铜离子和镍离子;溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤、干燥等步骤;
(4)电池反应为可充电电池为二次电源,阳离子交换膜阻止Br2与Zn直接化合;
解答 解:用含锌废催化剂(主要含ZnO,杂质有FeO、CuO、NiO及SiO2)加入 HBr溶液酸浸过滤,杂质中ZnO、FeO、CuO、NiO溶解,二氧化硅不溶,过滤得到滤渣1为SiO2,滤液中加入过氧化氢氧化亚铁离子生成铁离子,调节溶液PH4.5沉淀铁离子,过滤得到滤渣2为Fe(OH)3,滤液中加入过量锌除去铜和镍,过滤3得到铜和镍金属和过量锌,滤液为溴化锌溶液,蒸发浓缩、冷却结晶、过滤洗涤、干燥得到溴化锌晶体,
(1)提高浸取速率可以提高温度、加快搅拌、粉碎固体、增大浓度等措施,过滤1得到滤渣是二氧化硅,化学式为:SiO2,
故答案为:粉碎废催化剂、适当提高浸取时温度、适当提高HBr溶液浓度、搅拌等;SiO2;
(2)滤渣2为沉淀氢氧化铁,化学式为:Fe(OH)3,
故大答案为:Fe(OH)3;
(3)加入过量锌粉和铜离子、镍离子反应除去铜离子和镍离子;溶液中得到溶质固体的方法是蒸发浓缩、冷却结晶、过滤洗涤、干燥等步骤,试剂X为Zn或锌粉,操作Y为蒸发浓缩、冷却结晶,
故答案为:Zn或锌粉;蒸发浓缩,冷却结晶;
(4)电池反应为可充电电池为二次电源,阳离子交换膜阻止Br2与Zn直接化合;
故答案为:二; 阻止Br2与Zn直接化合.
点评 本题考查了物质分离提纯、物质性质、除杂方法、原电池和电解池原理等知识点,掌握基础是解题关键,题目难度中等.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2CH2OH+HBr $\stackrel{△}{→}$CH3CH2CH2Br+H2O | |
| B. | 服用阿司匹林过量出现水杨酸(  )中毒反应,可静脉注射 NaHCO3溶液: )中毒反应,可静脉注射 NaHCO3溶液: +2 HCO3-→ +2 HCO3-→ +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向丙氨酸钠中加入足量盐酸: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁和稀盐酸反应:S2-+2 H+→H2S↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O、18O互为同位素 | |
| B. | 金刚石和石墨互为同素异形体 | |
| C. | 分子式符合通式CnH2n+2 且 n 值不同的两种烃互为同系物 | |
| D. | C2H6和C2H6O互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 建立防风固沙带 | B. | 推广清洁能源 | ||
| C. | 随意丢弃废旧电池 | D. | 开展植树造林 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
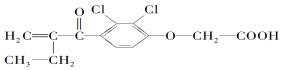
| A. | 该物质属于芳香族化合物,分子式为C13H14O4Cl2 | |
| B. | 该物质分子内处于同一平面的碳原子不超过7个 | |
| C. | 1mol该物质最多可与5molH2发生加成反应 | |
| D. | 1mol该物质最多可与含3molNaOH的水溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 有机物B的名称为乙醛,结构简式为CH3CHO.
有机物B的名称为乙醛,结构简式为CH3CHO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com